武汉大学黄理志团队WR:CO2地质封存能去除地下水中新污染物——次生碳酸盐矿的重要作用
图文摘要
成果简介
近日,武汉大学黄理志团队在Water Research上发表了题为“CO2 geological sequestration can remove emerging contaminants in groundwater: The important role of secondary mineral carbonates”的论文。该研究揭示了CO2注入地下水后,通过矿物的快速溶解释放Ca(II)、Mg(II)和Fe(II),并形成次生碳酸盐矿物(如CaCO3、MgCO3和FeCO3)。在氧化条件下,原位生成的FeCO3能够激活氧气产生羟基自由基(•OH),从而增强地下水中有机污染物的降解,如2,4,6-三溴苯酚、氟比洛芬、双氯芬酸、卡马西平、苯酚和磺胺甲恶唑。机制研究表明,这一过程得益于FeCO3转化为二维针铁矿纳米片结构,提供了更大的比表面积,使得更多的Fe(II)吸附在矿物表面。Fe-O配位键的形成有效减少了界面反应层中•OH的损失。研究进一步区分和量化了不同Fe(II)形态对•OH生成的贡献,并分析了六种污染物的转化路径及其中间产物的毒性。CaCO3和MgCO3虽然不具备降解污染物的能力,但在碳矿化过程中发挥了重要作用。该工作揭示了通过CO2矿化和封存过程生成的次生矿物具有同时降解污染物和固定碳的能力,不仅对地下水中有机污染物的环境命运和转化具有重要意义,也对碳循环的调控具有重要影响。
引言
碳捕集、利用与封存(CCUS)技术被认为是减少人为二氧化碳(CO2)排放和缓解全球变暖的有效手段,尤其是在具有广泛分布和显著CO2封存能力的地质环境中。然而,地下CO2、水和矿物之间的相互作用尚未完全阐明,包括含水层矿物的CO2捕获潜力以及重金属和有机化合物对地下水的污染风险。CO2的直接注入会降低地下水的pH值,改变地球化学过程,增加有毒无机成分(如铅、砷和锰)的溶解度,导致重金属离子的浸出。此外,CO2溶解有机化合物的能力引发了对这些物质从深部迁移至浅层地下水并引发二次污染的担忧。铁介导的碳自然循环和封存是环境系统中的关键过程,Fe(II)矿物在有氧条件下可激活O2生成羟基自由基(•OH),降解地下水中的有机污染物。然而,常用于CO2封存的地质矿物(如玄武岩和橄榄石)通常Fe(II)含量较低,限制了其在水-矿物界面的氧化还原反应能力。研究表明,CO2溶解矿物中的结构Fe(II)后,其浓度仍然较低,尚不清楚这些Fe(II)是否能增强O2激活生成•OH。此外,碱性硅酸盐矿物(如玄武岩和辉石)可以中和碳酸水的pH值,释放的二价阳离子(如Ca(II)、Mg(II)和Fe(II))可与CO2反应形成碳酸盐矿物。尽管已有研究关注碳酸盐矿化的封存效率,但对这些次生矿物的氧化还原活性及其驱动O2激活的主要活性物种仍存在疑问。FeCO3作为天然菱铁矿的主要成分,在促进污染物还原或氧化去除方面显示出潜力,但其在CO2矿化和封存过程中同步形成的有机污染物氧化过程研究仍存在空白。本研究旨在探讨CO2溶解是否促进矿物中二价阳离子的浸出及次生碳酸盐矿物的形成,评估这些次生矿物是否增强有氧条件下新兴地下水污染物(如2,4,6-三溴苯酚(TBP))的降解,并阐明其降解产物的环境毒性和转化机制。
图文导读
次生矿物碳酸盐的形成
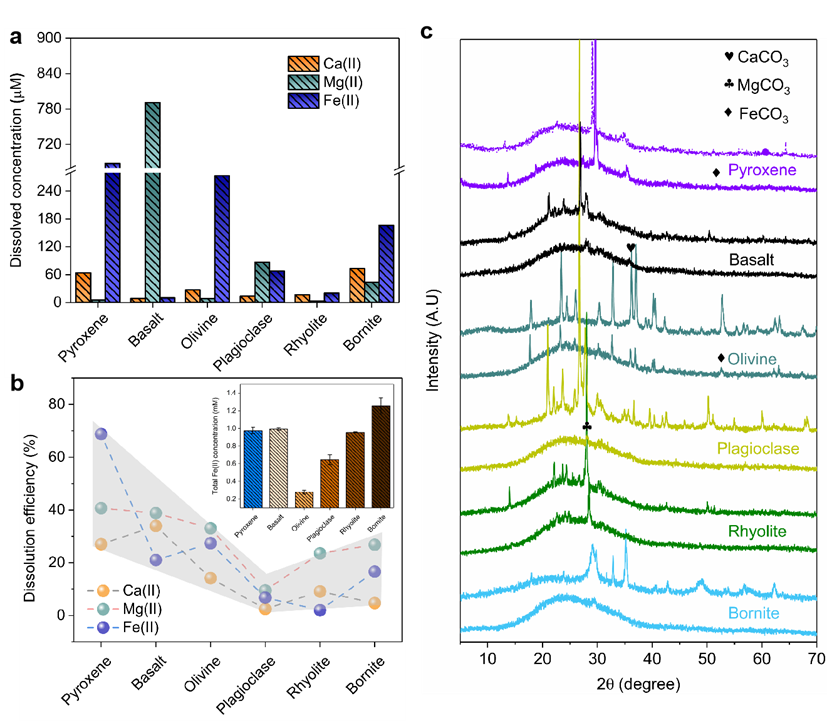
图1:六种矿物在CO2饱和水中的Ca(II)、Mg(II)和Fe(II)溶解及次生碳酸盐矿物的形成。(a) Ca(II)、Mg(II)和Fe(II)溶解浓度,(b) 不同矿物中Ca(II)、Mg(II)和Fe(II)的溶解百分比,(c) 反应前后矿物-CO2体系的XRD表征(缺氧条件)。反应器含1 g/L矿物,反应时间为24小时。
在引入CO2后,观察到六种矿物中Ca(II)、Mg(II)和Fe(II)离子的溶解。其中,斑铜矿溶解的Ca(II)浓度最高(73 μM),玄武岩溶解的Mg(II)浓度最大(790 μM),辉石溶解的Fe(II)浓度最高(687 μM)。这些现象归因于CO2加入后溶液的酸化,促进了矿物中二价阳离子的溶解(图1a)。Fe(II)的溶解百分比在辉石中最高(69%),在玄武岩中最低(1%)。Ca(II)、Mg(II)和Fe(II)的溶解效率趋势相似(图1b),受阳离子与氧原子键合特性的影响。24小时后,所有矿物溶液的pH值升至中性或碱性,Ca(II)、Mg(II)和Fe(II)离子更容易与碳酸盐结合形成次生碳酸盐矿物(如CaCO3、MgCO3和FeCO3),表明CO2的引入促进了这些矿物的形成,增强了碳封存能力(图1c)。
次生矿物碳酸盐对TBP的降解
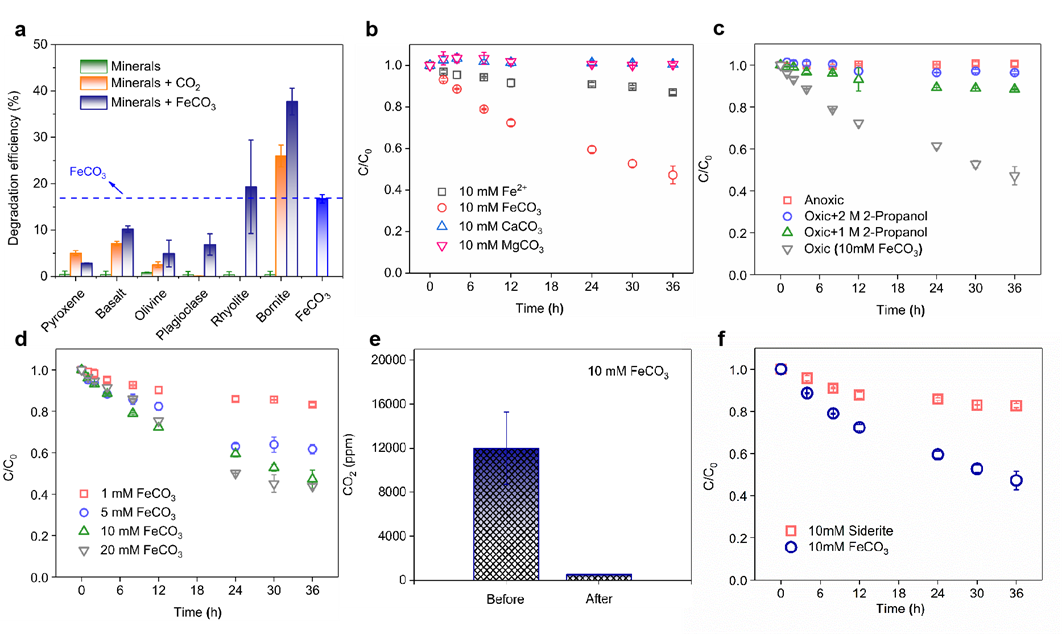
图2:(a) 矿物、矿物-CO2、FeCO3和矿物-FeCO3体系对TBP的降解,(b) 次生矿物碳酸盐对TBP的降解,(c) 次生矿物FeCO3与2-丙醇的淬灭实验,(d) 不同FeCO3浓度下的TBP降解,(e) 反应前后CO2量的变化,(f) 菱铁矿和FeCO3体系中的TBP降解。反应条件:5 μM TBP,pH 7.3,10 mM FeCO3。
石、玄武岩、橄榄石和斑铜矿分别表现出5%、7%、3%和26%的TBP降解效率,而斜长石和流纹岩体系的降解效果与未加CO2时相似(图2a),主要由于溶解的Fe(II)浓度过低。尽管TBP降解效率与溶解Fe(II)浓度无显著线性相关性,但FeCO3的加入显著提升了所有矿物体系的降解效率,且Fe(II)-CO2体系在相同Fe(II)浓度下比单独Fe(II)体系更有效。进一步研究表明,CaCO3和MgCO3对TBP降解无促进作用,而FeCO3在36小时内的TBP降解效率达58%,是Fe(II)体系的3.1倍。无氧条件下TBP浓度几乎不变,排除了吸附或挥发导致的损失(图2b,c)。随着FeCO3浓度从1 mM增至10 mM,TBP降解效率显著提高,速率常数(ki)从3.82×10-3 min-1增至23.38×10-3 min-1;浓度进一步增至20 mM时,效率略有提升,ki值小幅增加至25.41×10-3 min-1 (图2d),可能与实验装置中的传质限制有关。此外,反应后约5%的初始CO2以次生矿物FeCO3形式固定(图2e),表明FeCO3具有同时实现脱卤和碳封存的潜力。FeCO3对TBP的降解效率是天然菱铁矿的3.2倍(图2f),表明形成的次生矿物FeCO3比菱铁矿具有更高的氧化活性。为了检验•OH在TBP降解中的参与,通过添加2-丙醇进行了淬灭实验。当不同浓度的2-丙醇作为•OH淬灭剂加入FeCO3体系时,TBP降解效率降至5%。
机制研究
自由基生成
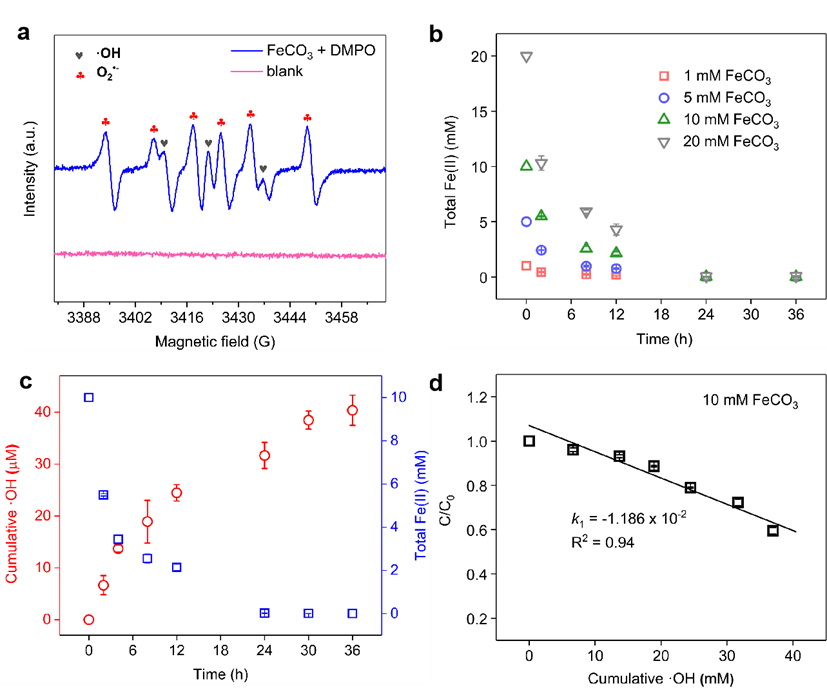
图3:氧化条件下FeCO3的反应过程。(a) EPR光谱,(b) 不同FeCO3浓度下的总Fe(II),(c) 累积•OH浓度和总Fe(II)浓度的变化,(d) 累积•OH浓度与TBP降解效率的关系。反应条件:5 μM TBP,pH 7.3,10 mM FeCO3。
如图3a所示,在氧化条件下,EPR光谱显示出与•OH生成相对应的明显峰。与其他含Fe(II)矿物类似,次生矿物FeCO3体系中•OH的生成被认为是由于矿物结合的Fe(II)(结构和吸附态)的氧化。为了验证这一假设,监测了FeCO3体系中的总Fe(II)浓度和累积•OH生成量。由于溶液中溶解的Fe(II)离子浓度低于检测限且对ROS生成的影响最小,因此未在图中展示。如图3b所示,总Fe(II)浓度在开始时迅速下降,但随着反应的进行逐渐减缓。这种现象在较高FeCO3浓度(10 mM和20 mM)下更为明显。•OH的积累随着悬浮液中总Fe(II)浓度的降低而增加,并与TBP降解效率密切相关(图3c,d),表明生成的•OH负责TBP的氧化,与FeCO3衍生的Fe(II)氧化密切相关。
铁物种在次生矿物碳酸铁(FeCO3)中的转化过程

图4:(a-d) 反应前后FeCO3的XPS光谱,(e, f) 反应前后FeCO3的穆斯堡尔光谱。
通过扫描电子显微镜(SEM)观察到,FeCO3颗粒逐渐形成具有更大比表面积的二维纳米片结构,XRD分析确认为针铁矿。XPS、Mössbauer光谱和FTIR分析表明(图4),FeCO₃在氧化过程中表面吸附的Fe(II)含量增加,电子结构发生变化,部分电子从Fe(II)向Fe-O键转移,形成π键,氧化态增加。Mössbauer光谱显示,反应36小时后,Fe(II)双峰面积减少,四极分裂参数增加,表明Fe(II)在FeCO₃表面形成Fe-O配位结构,同时生成新的针铁矿相。这些结果表明,Fe(II)在二维针铁矿纳米片表面以Fe-OH或Fe-O-C配合物形式存在,可能促进•OH积累,从而有效去除污染物。
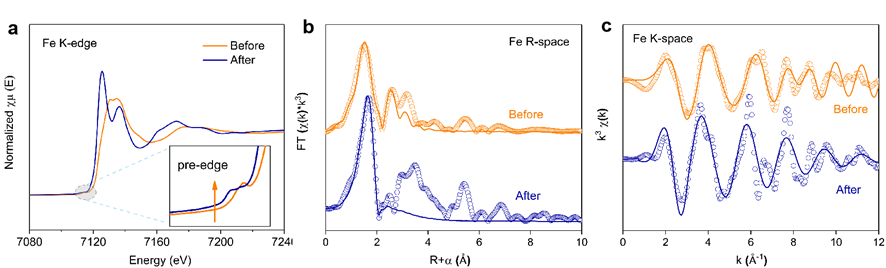
图5:(a) Fe K-edge XANES光谱,(b) R空间和(c) K空间的EXAFS拟合曲线(反应前后FeCO3)。
通过XANES和EXAFS分析,研究了FeCO3在有氧条件下反应前后Fe(II)配位结构的变化(图5)。结果表明,反应后Fe-K吸收边前缘位置向高能方向移动,表明Fe(III)矿物的形成。Fe-O键长从2.04 Å增加到2.12 Å,配位数增加,表明Fe(II)/Fe(III)-O配合物的形成。反应后FeCO3表面Fe-O配位结构以Fe(II)-O为主,R空间增强表明Fe-O配位数增加,降低了Fe(II)的电子密度,减缓了氧化速率,减少了界面反应层的Fe(II)损失,从而提高了•OH的产率。综上所述,有氧条件下,FeCO₃溶解的Fe(II)在矿物表面吸附形成Fe-O配位结构,不仅诱导FeCO₃转化为具有更多活性吸附位点的二维针铁矿相,还降低了周围电子密度,减少•OH消耗,有效提高了次生矿物体系降解污染物的氧化能力。
铁物种对CO2诱导产生•OH的贡献
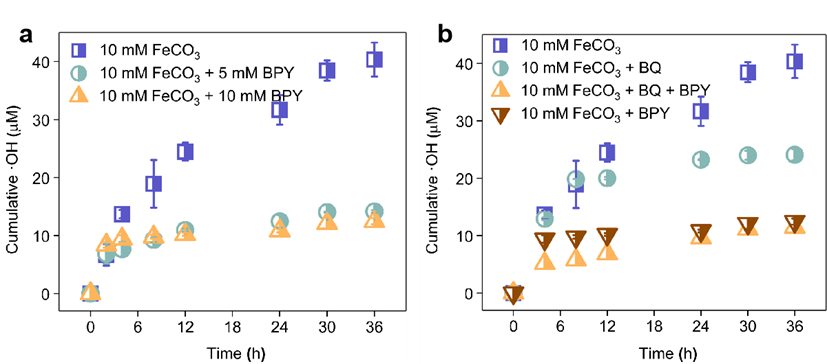
图6:BPY和BQ对•OH生成的影响。反应条件:0.5 mM BQ,10 mM BPY,pH 7.3,氧化条件。
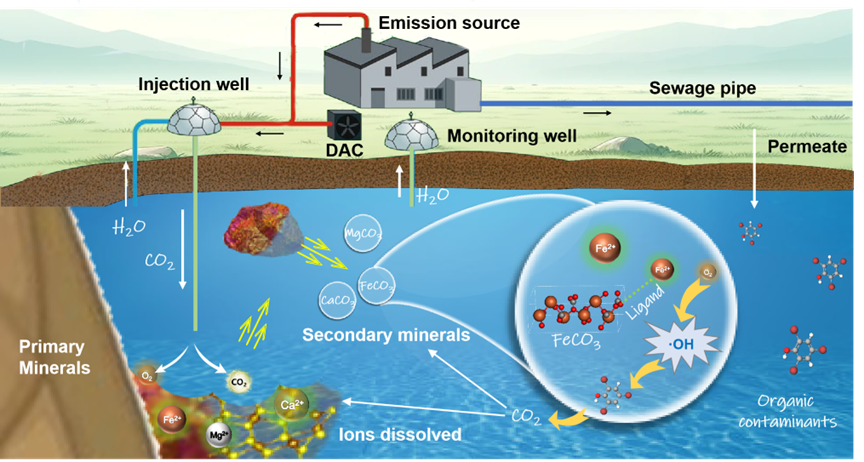
为阐明结构Fe(II)和表面吸附Fe(II)对•OH生成的贡献,向反应体系中加入络合剂2,2'-联吡啶(BPY),结果显示BPY存在时•OH产量仅为无BPY时的31.1%(图6),表明68.9%的•OH由表面配位Fe(II)活化O2生成。加入苯醌(BQ)作为O2•−清除剂后,•OH产量减少50.2%,表明O2•−参与O2还原为•OH的过程。EPR表征证实FeCO3通过单电子转移机制还原O2生成•OH。当同时加入BPY和BQ时,•OH产量未显著下降,表明结构Fe(II)主要通过双电子转移机制活化O2,而表面吸附Fe(II)则通过单电子转移机制生成O2•−、H2O2和•OH。表面吸附Fe(II)主要来源于结构Fe(II)的溶解和再吸附,FeCO3表面形成的二维针铁矿纳米片结构提供了更多活性吸附位点,增强了Fe(II)的吸附能力。CO2注入地下水后,H2CO3形成并降低pH,促进Ca(II)、Mg(II)和Fe(II)等二价阳离子从原生矿物中溶解,随后与CO32-反应生成CaCO3、MgCO3和FeCO3等次生矿物颗粒,其中FeCO3可活化O2生成•OH,有效降解污染物。
背景离子影响
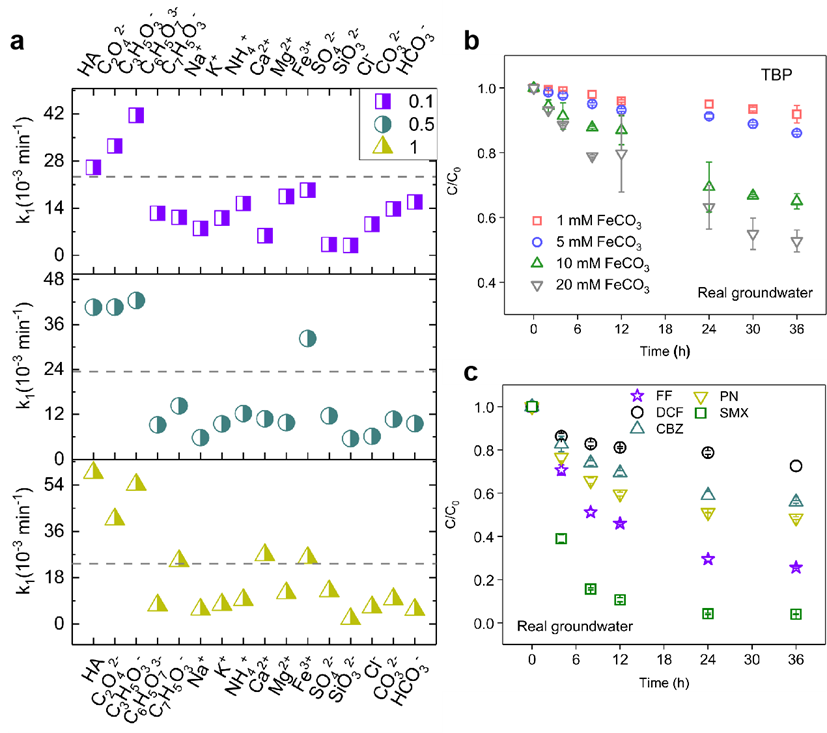
图7:(a) 不同离子存在下TBP降解的反应速率常数图(灰色虚线表示未添加任何离子的FeCO3体系的速率常数),(b) 实际地下水中TBP和(c) 其他污染物的降解效率。反应条件:5 μM污染物,pH 7.3,10 mM FeCO3。
图7显示了地下水中常见无机离子(Na⁺、K⁺、NH₄⁺、Ca²⁺、Mg²⁺、Fe³⁺、SO₄²⁻、SiO₃²⁻、Cl⁻、CO₃²⁻、HCO₃⁻)和有机酸离子(腐殖酸、C₂O₄²⁻、C₃H₅O₃⁻、C₆H₅O₇³⁻、C₇H₅O₃⁻)对TBP降解的影响。有机酸通过促进FeCO3溶解及与Fe(II)络合提升TBP降解效率;Ca²⁺、Mg²⁺、Na⁺、K⁺、NH₄⁺抑制降解;Fe³⁺高浓度下因水解酸化促进降解;SO₄²⁻、SiO3²⁻、Cl⁻、HCO₃⁻通过清除•OH降低FeCO3活性。实际地下水中TBP降解效率降低,归因于阴阳离子的抑制作用。
污染物降解产物及毒性分析

图8:(a) 10 mM FeCO3对不同污染物的降解,(b) TBP的转化路径,(c-h) TBP及其转化产物对鱼类、水蚤和绿藻的急性和慢性毒性的Log10值(ECOSAR估算)。
FeCO3不仅能有效降解TBP,还对FF、DCF、CBZ、PN和SMX等地下水常见污染物具有降解能力。通过HPLC-MS技术鉴定了TBP的降解中间产物(2-溴苯酚和2-溴-1,4-苯醌),并提出了其降解路径。毒性评估显示,除DCF外,其他污染物的降解产物毒性显著降低(图8),表明FeCO3具有降低污染物对地下水环境生态风险的潜力。
小结
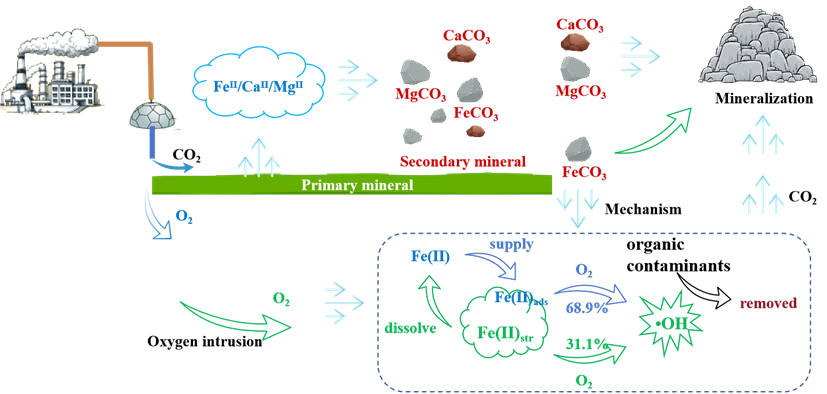
图9:CO2注入诱导的次生矿物形成、•OH生成及污染物氧化示意图。
本研究强调了在CO2矿化和封存过程中原位生成的次生矿物FeCO3在促进氧化降解和碳固定方面的双重作用,为同时实现CO2封存和地下水修复提供了一种有前景的方法。FeCO3表面以Fe-O结构存在的吸附Fe(II)通过提供更多的活性位点和降低Fe(II)的电子密度,增强了O2的活化以生成•OH。结构和吸附Fe(II)对•OH生成的贡献率分别为31.1%和68.9%。淬灭实验结果表明,•OH在污染物降解中发挥了重要且直接的作用,实现了TBP(52.7%)、FF(25.1%)、DCF(32.3%)、CBZ(55.9%)、PN(58.9%)和SMX(81.2%)的高效降解。ECOSAR程序的毒性评估表明,这六种污染物的氧化中间产物在降解过程中对生态风险的影响逐渐减小。在实际地下水中,次生矿物FeCO3仍表现出良好的污染物降解效率,天然有机物和有机酸的存在表现出促进作用。这些结果表明,次生矿物在增强地下水原位修复策略和推进CO2地质封存方面的潜力。
本项目得到了国家自然科学基金委、中央高校基本科研业务费专项资金项目和武汉大学人才引进启动经费。