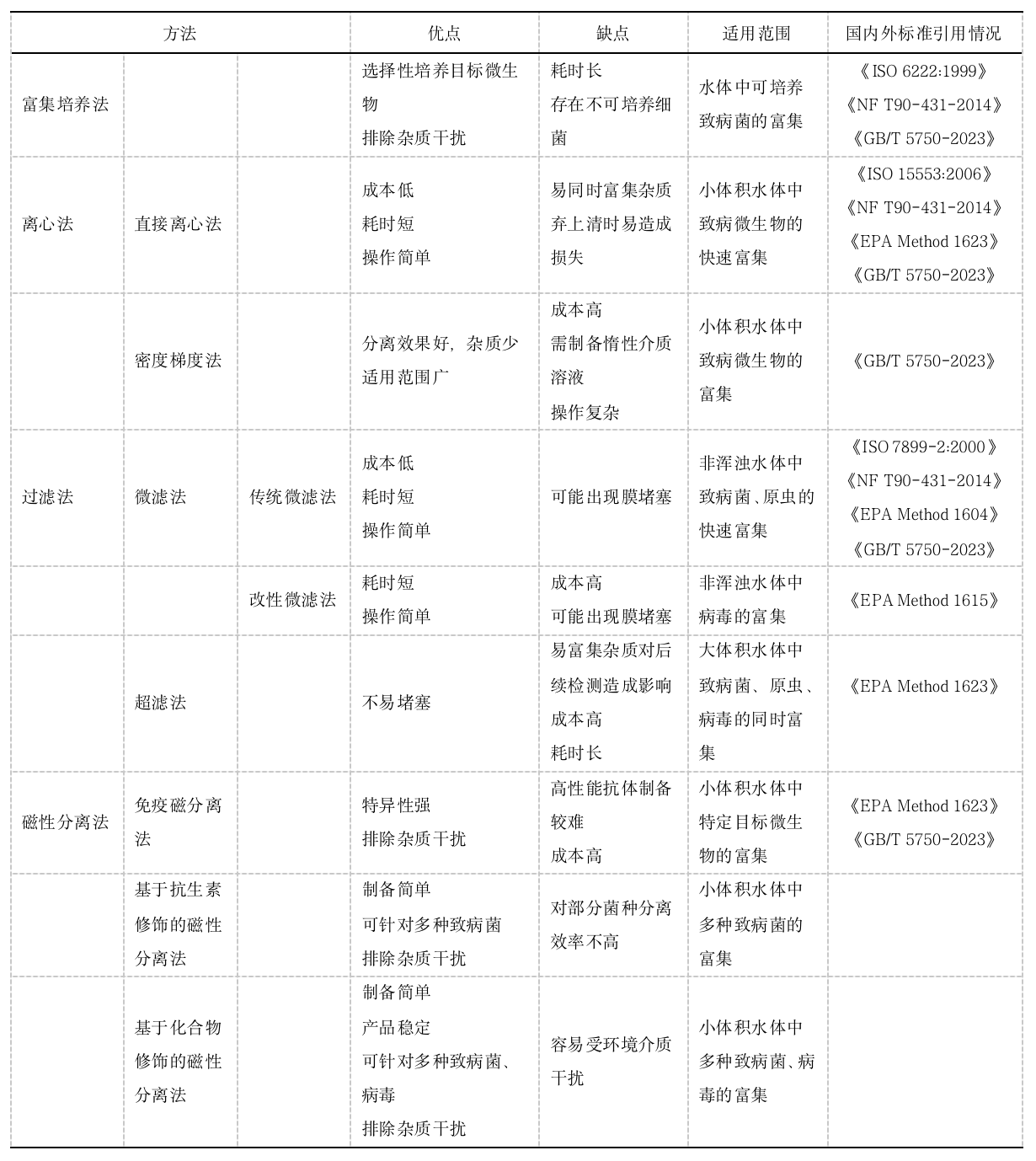
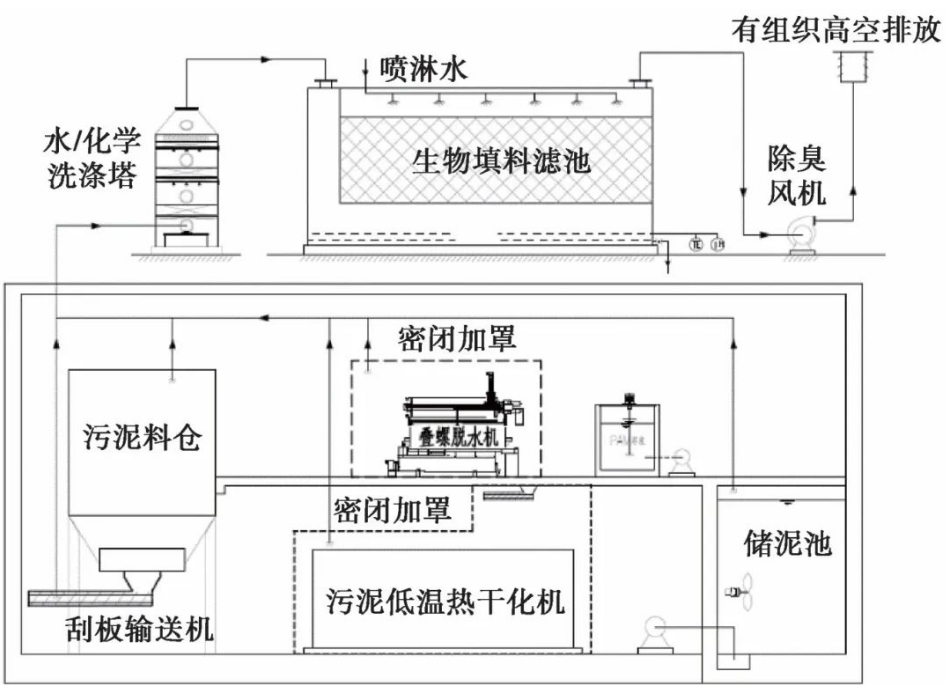
水体致病微生物检测中样品前处理方法
水中的微生物水平(细菌、病毒、原虫等)是衡量水质安全的重要指标,水源性致病微生物通过饮水和直接接触等途径感染人体,存在传播各类疾病的风险,关乎人群生命健康。由于致病微生物在环境水体中通常以较低浓度存在,在检测过程中均需先对水样进行前处理将其浓缩成较小的体积。本文介绍了可用于水体中致病微生物富集浓缩的富集培养、离心、过滤和磁性分离等前处理方法的研究进展,讨论了不同前处理方法的优缺点和适用范围,以实现水体中致病微生物的准确检测,真实反映致病微生物在水体中的赋存状况,为水体中致病微生物分析检测和风险控制提供技术支撑。
研究背景
水是人类赖以生存的物质,但水中存在的各类污染源会损害人类和动物的健康。水是传染病传播流行的重要途径之一。研究表明,水中的微生物尤其是致病微生物是介水传染病传播的重要因素,主要包括细菌(霍乱弧菌、大肠埃希氏菌、弯曲杆菌和沙门菌等)、病毒(诺如病毒、肠道病毒、甲型肝炎病毒和轮状病毒等)和原虫(隐孢子虫、贾第鞭毛虫、溶组织内阿米巴虫和圆孢子虫等)。根据美国疾病预防控制中心疫情报告系统的数据,美国在1971至2020年期间因饮用水中致病微生物(包括14种细菌、3种病毒和5种原虫)污染共引起675起疫情,累计造成497140人患病,276人死亡。历史上霍乱弧菌曾引发多次世界范围内的霍乱大流行;由沙门菌、志贺菌、大肠埃希氏菌等引起的细菌性腹泻在发展中国家也十分常见;此外,过去各国研究者对军团菌的研究都聚焦在喷泉水和空调冷却水上,但近年来饮用水系统被军团菌污染的事件也多有发生,2020年美国疾病预防控制中心办公楼因在供水系统中发现军团菌而被封闭。因此,通过水质检测对环境水体及饮用水中的致病微生物开展风险排查至关重要。
目前水中致病微生物的标准检测方法基本都基于培养法进行检测,但是培养法因某些因素可能会导致细胞计数不完全,如微生物受到非致命性的伤害、微生物不可培养、生长温度不适宜、生长周期不满足、超过非自养的存在时间等。近年来,国内外基于不同的检测原理研发了多种更加便捷快速的检测技术,如环介导等温扩增技术(LAMP)基于ATP的生物荧光检测、以及荧光定量PCR等。其中,分子生物学技术因具有高特异性和快速检测的特点而逐渐得到广泛应用,这些方法可快速对多种致病微生物进行高通量检测,但在水体中的应用主要受限于三个因素:(1)水体中致病微生物存在水平较低;(2)存在抑制分子生物技术(如PCR)的干扰物质(如盐度、腐殖酸);(3)游离核酸(死细胞释放的核酸)的持久性,导致在随后的分子检测方法中出现假阳性信号。因此,为了对水源性致病微生物进行更为准确灵敏的分析,采取适宜的前处理方法,对其进行有效的富集和净化是非常有必要的。目前,国内外仅对水体中肠道病毒的富集浓缩方法有相关报道,但对致病微生物富集浓缩方法相关研究进展的总结分析较少,本文总结了水体致病微生物前处理方法的最新研究进展,分析了不同方法的优缺点和应用特点,以期为致病微生物高效便捷的方法研究与应用提供理论基础和科学依据。
1、富集培养法
富集培养法是采用培养的方法对水样中目标微生物进行增殖,以达到富集的目的。根据微生物呼吸类型,富集培养法可分为好氧培养与厌氧培养。但是大多数微生物(大多数细菌,霉菌,放线菌等)需要有氧条件下进行培养,培养的方法主要有:(1)固体培养法:在培养基表面(如斜面与平板表面)完成微生物增殖培养;(2)液体培养法:把微生物接种到液体培养基中进行增殖培养。Wang 等开发了经过10~24 h培养后用PCR检测水中大肠埃希氏菌和肠球菌的方法,检出限可达到0.2 MPN/mL。Strakova 等通过一种基于离心、细菌运动和选择性培养条件的新型培养方法对废水和地表水中的耐热弯曲杆菌进行分离,在44%的样品中检出弯曲杆菌阳性。从现有的研究来看,富集培养法在致病菌的富集浓缩中应用较多,对病毒和原虫的富集浓缩常采用的是鸡胚及鸡胚器官培养和细胞培养的体外培养模型,但这种方法目前主要应用于药物的开发,在水体中的应用较少。
鉴于细菌培养过程中大部分选择性培养基只能培养特定的目标菌株,无法满足多种致病菌高通量检测的需求,目前开发多重选择性培养液以实现多种致病菌的同时培养成为了一个新的研究热点。Suo 等开发了一种可以同时培养大肠埃希氏菌O157:H7、沙门菌属和单核细胞增生李斯特氏菌3种致病菌的SEL培养液,在100~102 CFU/mL接种浓度下,三种目标菌株经过1 h非选择性恢复期再37 ℃选择性培养20 h后均可富集到108~109 CFU/mL。Qu 等开发了一种可以同时培养沙门菌、金黄色葡萄球菌、大肠埃希氏菌 O157: H7 和单核细胞增生李斯特菌的SSEL培养液,在101~102 CFU/mL接种浓度下四种目标菌体37 ℃培养18 h后均可富集到105 CFU/mL。
富集培养法的优点是可以选择性培养目标菌株,同时可排除死菌和其他杂质的干扰(如非目标微生物、腐殖质等),但该方法培养过程耗时且只适用于可培养的细菌或真菌的富集,限制了其在致病微生物检测的前处理过程中的研究和应用。
2、离心法
基于离心的前处理方法是利用离心力使大小、形状、密度和介质粘度不同的颗粒从液体介质中分离出来,是分子生物学实验室中最常用的技术之一,主要包括直接离心法和密度梯度离心法。
2.1直接离心法
直接离心法是直接对水中的微生物进行离心,通过将大部分微生物沉降于管底来达到分离及富集浓缩的目的。根据目标微生物的大小不同可选择不同的离心条件,原虫体积较大,直径>3 μm,选用的离心力一般为(500~2000)×g;细菌直径一般为0.5~10 μm,常用的离心力范围为(3000~12000)rpm;病毒直径一般为0.01~0.1 μm,常用的离心力范围为 (90800~171000)×g。Beheshti Maal 等以8000×g离心10 min后提取DNA的方法对伊朗伊斯法罕南部污水处理厂的进水水样进行大肠埃希氏菌菌株的分离鉴定。《生活饮用水标准检验方法》(GB/T 5750-2023)采用Filta-Max Xpress快速方法对饮用水中贾第鞭毛虫/隐孢子虫进行测定时,采用的分离条件是2000×g离心15 min。Ahmed 等对澳大利亚布里斯班某城市污水处理厂的进水水样进行小鼠肝炎病毒测定时采用的分离条件是以100000×g在4 ℃下离心1 h,之后提取RNA并结合RT-qPCR完成检测,回收率为33.5 ± 12.1%。
直接离心法的优点主要体现在以下几个方面:
①方法成本只涉及离心机的初始投资,使用中不需要化学试剂或其他昂贵的消耗品;②速度快,可以在相对较短的时间内完成大体积水样的处理;③方法操作简单,技术要求低,操作过程中不会引入其他物质、试剂,对目标微生物影响较小。
直接离心法也存在不足之处:①在富集目标微生物的同时会对其他颗粒进行富集,特别是对于高浊度的水样,容易对后续操作(如核酸提取、PCR检测等)造成影响;②离心后倾倒上清液时易造成目标微生物损失。
2.2密度梯度离心法
密度梯度离心法是用一定的惰性介质(蔗糖、甘油等)在离心管内形成连续或不连续的密度梯度,根据微生物在密度梯度液中的比重不同,通过离心力的作用使目标微生物分离的一种技术。Garrison 等在弗吉尼亚州诺福克的拉斐特河和海湾流淌的水中加入大肠埃希氏菌和鞭毛虫后,采用蔗糖密度梯度离心法实现了对两种微生物的富集。Chesnot等采用不同惰性介质的密度梯度离心法实现了浑浊水样中隐孢子虫卵囊的富集,已发布的《生活饮用水标准检验方法》GB/T 5750-2023中两虫检测中也新增了密度梯度法。Hinzke 等使用蔗糖密度梯度离心法根据微生物大小从海水中富集了细菌共生体。
密度梯度离心法的优点:
①分离效果好,可一次获得杂质较少的目标微生物;②适用范围广,既能分离沉降系数不同的颗粒,又能分离密度不同的颗粒;
该法存在的局限性:
①成本昂贵;②需要制备惰性介质溶液;③操作复杂,不易掌握。
3、过滤法
过滤技术是以压力作为推动力的一种膜分离技术,膜孔径范围从小于2 nm到大于20 μm不等。其分离机理主要有两种:
(1)机械筛分,通过膜截留比膜孔径大或与其孔径相当的微生物颗粒;
(2)吸附截留,当微生物穿过膜表面进入膜内部时,利用膜自身的物理化学性质和静电引力使微生物沉积在膜孔侧壁或膜内部基质上。根据膜孔径大小,过滤技术可被分为微滤、超滤、纳滤和反渗透,在微生物前处理过程中主要采用微滤和超滤技术。
4、磁性分离法
磁性分离是以磁性或可磁化的材料作为吸附剂的一种分离富集技术。大多数应用于分离的磁性材料具有超顺磁性,即在通常情况下没有磁力,在外加磁场下可表现出磁性。在没有磁场的情况下可以充分地分散在溶液中,与目标物结合,之后在外加磁场下聚集于容器一侧,通过弃去溶液和重复洗涤来最大限度地去除抑制物。磁性材料只是载体,只有对磁性纳米材料(Magnetic Nanoparticles,MNPs)进行表面修饰,使其具有抗体、抗生素(万古霉素、达托霉素等)和化合物等识别基团才能捕获目标微生物。
4.1免疫磁分离法
免疫磁分离是指用抗体修饰MNPs,基于抗体-抗原相互作用从水体中选择性捕获目标微生物。Guven 等用IgE标记的免疫磁珠分离水样中的大肠埃希氏菌,结合免疫分析技术进行检测,检出限为8 CFU/mL。Quang 等用蛋白A偶联壳聚糖修饰的Fe3O4磁性颗粒结合IgG抗体从浓度低至10 CFU/mL水样中分离出了霍乱弧菌。我国施行的《生活饮用水标准检验方法 微生物指标》(GB/T 5750.12—2023)规定采用免疫磁分离荧光抗体法测定生活饮用水及其水源水中的贾第鞭毛虫孢囊和隐孢子虫卵囊。Villamizar-Gallardo等使用抗轮状病毒单克隆抗体功能化氟磁性纳米粒子实现了对水中轮状病毒的富集。
4.2基于抗生素修饰的磁性分离法
一些抗菌物质能够抗菌是因为能与致病菌表面的一些生物结构相互结合,利用这一特点将其与磁性粒子结合可以起到捕获细菌的作用。Meng等用万古霉素修饰的MNPs捕获水、牛奶和果汁饮料中的金黄色葡萄球菌,结合流式细胞仪,检出限为33 CFU/mL。Ding等用抗菌肽功能化磁性纳米颗粒在较低浓度下(0.1 mg/mL)实现了对致病性革兰氏阴性杆菌的半选择性捕获,在较高浓度下(0.5 mg/mL)实现了对自来水和休闲水中大肠埃希氏菌的高效捕获,捕获效率大于97%。
4.3其他
除了基于抗体和抗生素修饰的分离磁珠之外,还有一些其他经过化合物改性的磁珠被用于致病菌、病毒分离。Zhan等制备了一种新型的胺功能化磁性Fe3O4-SiO2-NH2纳米粒子,可捕获水中的病毒(脊髓灰质炎病毒1)和致病菌(金黄色葡萄球菌、大肠埃希氏菌O157:H7、铜绿假单胞菌、沙门菌和枯草杆菌),回收率为92%~96.3%。Huang 等报道了用胺基修饰的硅包Fe3O4磁性纳米粒子分离水和饮料中的大肠埃希氏菌、沙门菌、金黄色葡萄球菌等多种革兰氏阴性菌和革兰氏阳性菌,平均回收率达到了 88.5%~99.1%。Bohara 等用功能化铁酸钴纳米颗粒基于疏水作用捕获水样中的革兰氏阴性菌(大肠埃希氏菌)和革兰氏阳性菌(金黄色葡萄球菌),平均回收率分别为65%和95%。虽然这些化合物修饰的MNPs无法特异性的区分某个特定的种属或者菌株,但这种广泛性是抗体和抗生素等识别片段无法比拟的,因此这类磁珠的研究与开发也会是未来的热点方向之一。
以上各种磁性分离方法的优缺点汇总见下表,总的来说,磁性分离在致病菌和病毒前处理方面具有很大优势,可以快速有效地去除干扰物的同时富集目标微生物,无论是与分子检测方法还是其他检测方法结合都具有巨大的潜力,但局限在于其在水中原虫的富集应用较少,此外,影响其稳定性因素多。
表 各种磁性分离方法的优缺点汇总

研究结论
· 水体致病微生物污染可对人类和动物造成危害,引发介水传染病,而水体中致病微生物浓度低、基质复杂,对水样进行充分的前处理可以提高水体中致病微生物的检测能力;
· 从现有研究来看,常用的前处理方法主要包括富集培养法、离心法、过滤法、磁性分离法等;
· 各种水样前处理方法各有特点,在应用过程中可根据不同方法的优缺点和适用范围针对性进行选择;
· 基于现有前处理方法的不足,未来研发的重点应该是在最大可能排除杂质干扰的基础上努力减少前处理过程中目标微生物的损失,如开发水体杂质去除方法、开展水体中致病微生物的二次富集等,为实现水源性致病微生物高效、快速的检测及水源性疫情暴发早期预警提供基础。
表 水体致病微生物前处理方法的优缺点及其适用范围