华南师大应光国团队与环境监测总站、中科院亚热带农业所合作研究:河流金属抗性组与抗生素抗性组关联性
图文摘要
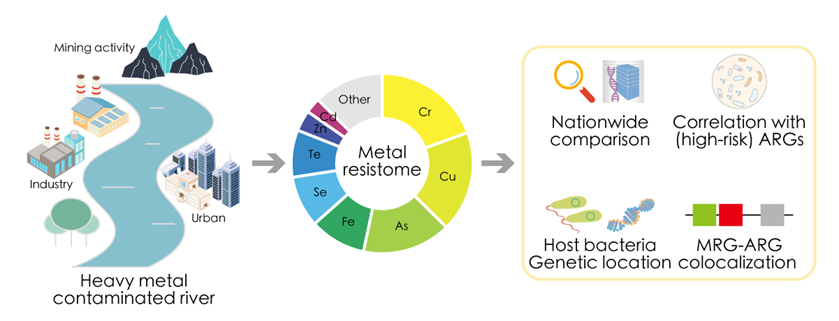
本文亮点
河流中广泛存在MRGs,但其丰度与金属浓度无显著相关性;
MRGs与ARGs之间存在显著的相关性,包括临床相关的ARGs;
Burkholderiaceae科和Pseudomonadaceae科是主要的MRGs宿主菌群;
来源于质粒的MRGs在河水中被频繁检出;
在河流环境中,MRGs与ARGs的共定位现象较为罕见。
摘要
重金属可通过共选择机制推动抗生素抗性的发展。目前的研究主要集中在河段尺度金属抗性基因(MRGs)与抗生素抗性基因(ARGs)之间的关系,而在大尺度流域层面,MRGs与ARGs之间的关联性及其共定位在抗性传播中的作用仍不明确。本研究采用宏基因组学方法,对历史上受到重金属污染的湘江流域中MRGs的流行特征及其与ARGs的关联进行了系统研究,结合抗性组谱分析与共定位分析,探讨了其潜在的传播机制。
研究结果表明,与全国其他河流相比,湘江中MRGs的丰度显著更高,但其在水体和沉积物中的丰度均与重金属浓度呈弱相关性。水体中MRGs的分布受非生物因子的影响较弱,而微生物群落组成对其具有显著的驱动作用。源自污水的MRGs比例与水体中MRGs的丰度呈显著正相关,表明外源废弃物输入在其中具有重要作用。来源于质粒的MRGs在水体中更为丰富,而沉积物中则以染色体上的MRGs为主,提示不同环境介质中存在差异化的转移机制。MRGs与ARGs在水体和沉积物中均呈显著相关性,且包括多种临床高风险的ARGs。然而,MRGs与ARGs的共定位事件较为罕见(共检出8例),这一发现与全国河流中共定位事件的低检出率(沉积物为3.5%,水体为2.0%)相一致,暗示其在抗性传播中的作用可能有限。
总体而言,本研究加深了对河流环境中金属抗性组及其与抗生素抗性组之间关系的认识,并强调了MRG-ARG共定位在河流环境中较为罕见,提示其在耐药性扩散中的潜在影响有限。
研究结果
积物中重金属污染水平较高
本研究在湘江流域沿线测定了砷、镉、铬、铜、镍、锰和铅等重金属的浓度。结果显示,不同采样点间金属浓度差异显著,标准差较大(图1b-c)。在沉积物中,金属总浓度范围为304–4540 mg/kg。其中,锰含量最高,平均浓度为1170 mg/kg;其次为砷(641 mg/kg)、铅(76.7 mg/kg)、铬(42.4 mg/kg)、铜(40.0 mg/kg)、镍(28.1 mg/kg)和镉(4.0 mg/kg)。值得注意的是,大多数采样点中各类金属的浓度均超过了国家背景值(图1b红线所示)。季节性分析结果表明,汛期锰和铜的浓度显著高于枯水期(p < 0.05)。
在水体中,金属总浓度范围为0.9–534 μg/L,同样以锰含量最高(107 μg/L),依次为砷(10.9 μg/L)、铜(5.4 μg/L)、铬(4.0 μg/L)、镍(3.7 μg/L)、铅(3.6 μg/L)和镉(0.4 μg/L)。部分采样点的金属浓度超过了国家地表水环境质量标准限值(图1c红线所示)。季节性分析进一步表明,汛期锰、砷、铜、镍和镉的浓度显著高于枯水期(p < 0.01)。
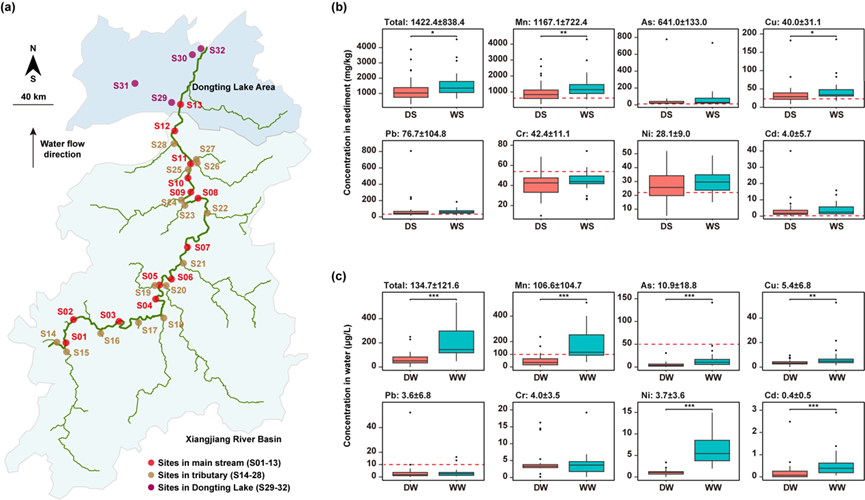
图1. 河流中金属含量概况。(a) 本研究的采样地图。(b) 沉积物中重金属浓度的箱线图。(c) 水体中重金属浓度的箱线图。每个图上方的数值表示金属浓度的平均值 ± 标准差。红色虚线表示水质标准限值(用于水体)或背景值(用于沉积物)。未绘制红线的图表示所有样品的金属浓度均低于相应限值或背景值。* 表示显著性水平为 0.05;** 表示显著性水平为 0.01;*** 表示显著性水平为 0.001。缩写说明:DS,枯水期沉积物;WS,丰水期沉积物;DW,枯水期水体;WW,丰水期水体;As,砷;Cd,镉;Cr,铬;Cu,铜;Ni,镍;Mn,锰;Pb,铅。
河流中广泛存在金属抗性基因,但其丰度与金属浓度无显著相关性
在湘江流域共鉴定出306种MRGs,涵盖23类抗性类型。其丰度在沉积物中为0.37–0.85拷贝/细胞,在水体中为0.36–1.43拷贝/细胞(图2a)。值得注意的是,水体中MRGs丰度在不同样本间的变异性高于沉积物。在两种介质中,对铬、铜和砷具有抗性的MRGs最为常见,沉积物中其平均丰度分别为0.11、0.12和0.15拷贝/细胞,水体中分别为0.24、0.21和0.14拷贝/细胞。
季节性分析显示,沉积物中三类MRGs(砷、铋、锑)在枯水期丰度显著升高,而六类MRGs(银、镉、铁、锰、镍和锌)在汛期丰度显著较高(p < 0.05)。在水体中,四类MRGs(砷、镁、钨和钒)在汛期丰度显著升高,而两类MRGs(镉和硒)在枯水期丰度较高(p < 0.05)。
为评估湘江流域金属抗性基因的流行特征,将其MRGs谱系与中国其他河流的全国样本进行比较分析。结果显示,在全国河流样本中,共检测到311种沉积物MRGs和319种水体MRGs,涵盖与湘江相同的23类抗性类型。统计分析表明,湘江流域沉积物和水体中MRGs的整体丰度均显著高于全国河流水平(p < 0.01,图2b)。在具体MRG类型上,沉积物中有14类、水体中有15类在两组河流间存在显著差异。其中,湘江流域中分别有8类MRGs在沉积物和水体中丰度显著更高,且多数为主要类型(p < 0.05)。
为探究MRGs与金属浓度之间的关系,采用Spearman秩相关分析评估湘江流域中金属含量与MRGs谱系之间的相关性。结果显示,无论是在沉积物还是水体中,金属元素与其对应MRG类型之间均未检测到显著相关性(p > 0.05,图2c)。在单一金属与MRGs丰度水平上,沉积物中未发现显著相关性;尽管水体中检测到20对显著相关关系,但这些关系未表现出稳定的特异性配对趋势。
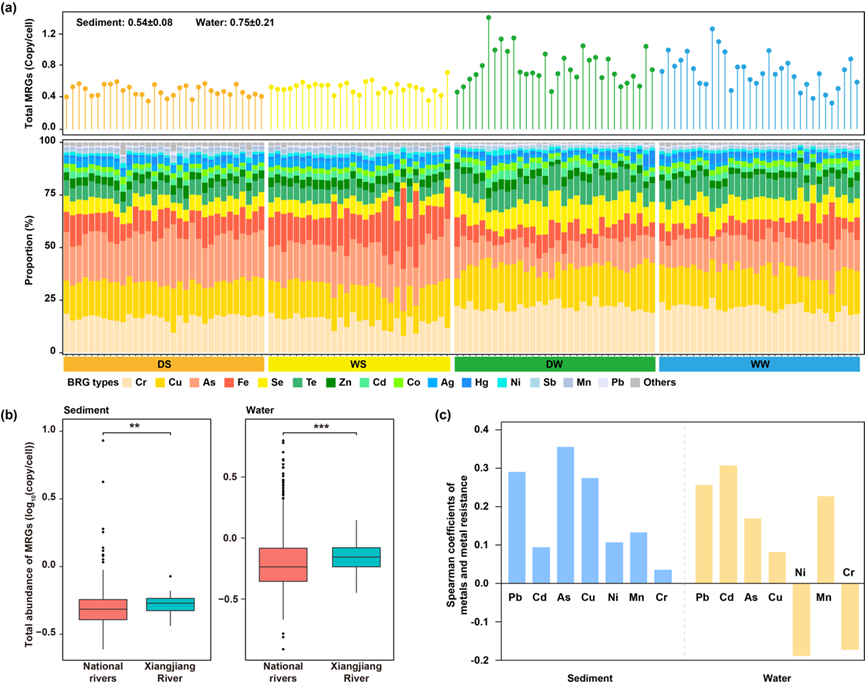
图2. 河流中MRGs特征。(a) 河流沿线各采样点的MRGs总丰度(上图)及各类型MRGs的相对比例(下图)。样本从左至右依次为S01至S32。上图中的数值表示MRGs总丰度的平均值 ± 标准差。(b) 湘江与全国河流中沉积物和水体中MRGs总丰度的相对丰度箱线图。(c) 金属含量与相应MRG类型之间的Spearman相关系数。** 表示显著性水平为 0.01;*** 表示显著性水平为 0.001。缩写说明:DS,枯水期沉积物;WS,丰水期沉积物;DW,枯水期水体;WW,丰水期水体;As,砷;Cd,镉;Cr,铬;Cu,铜;Ni,镍;Mn,锰;Pb,铅;Fe,铁;Se,硒;Te,碲;Zn,锌;Co,钴;Ag,银;Hg,汞;Sb,锑。
MRGs主要由Burkholderiaceae科和Pseudomonadaceae科细菌携带
在湘江流域共鉴定出573条沉积物MRG-contigs和1938条水体MRG-contigs。尽管部分属于同一基因家族的MRGs(如 mer、ars、cop)在contigs中存在共定位现象,但不同基因家族间的MRGs共定位较为罕见。在沉积物和水体中,Pseudomonadota门(即原来的变形菌门 Proteobacteria)是MRGs的主要宿主门类,分别占沉积物中MRG-contigs的71.4%和水体中的93.1%(图3a-b)。在沉积物中,多个细菌科和属仅携带少量MRG-contigs,故在图3a中归为“其他科”(50.3%)和“其他属”(77.7%)。从MRG类型来看,铜抗性基因具有最高的宿主多样性,共关联至147个属。沉积物中的主要宿主科包括Burkholderiaceae(18.3%)和Pseudomonadaceae(7.5%)。关键宿主属包括Gammaproteobacteria纲下一个未分类属(7.5%)、Pseudomonas_E(5.9%)和Nitrospira_D(3.8%)。在水体中,MRGs宿主的分布特征与沉积物显著不同(图3b)。超过一半的MRG-contigs(57.9%)由Burkholderiaceae科细菌携带,主要包括属如Limnohabitans_A(12.4%)、Limnohabitans(7.3%)和Aquabacterium(7.7%),以及其他58个属。这些属主要携带砷、钴、铜、镉、铅和锌的抗性基因。其次是Pseudomonadaceae科,占比7.1%,其中92.8%的MRG-contigs由Pseudomonas_E属携带。在物种水平上,沉积物中共鉴定出约360种MRGs宿主物种,水体中约为500种,表明该河流中金属抗性细菌具有广泛的分类学多样性。
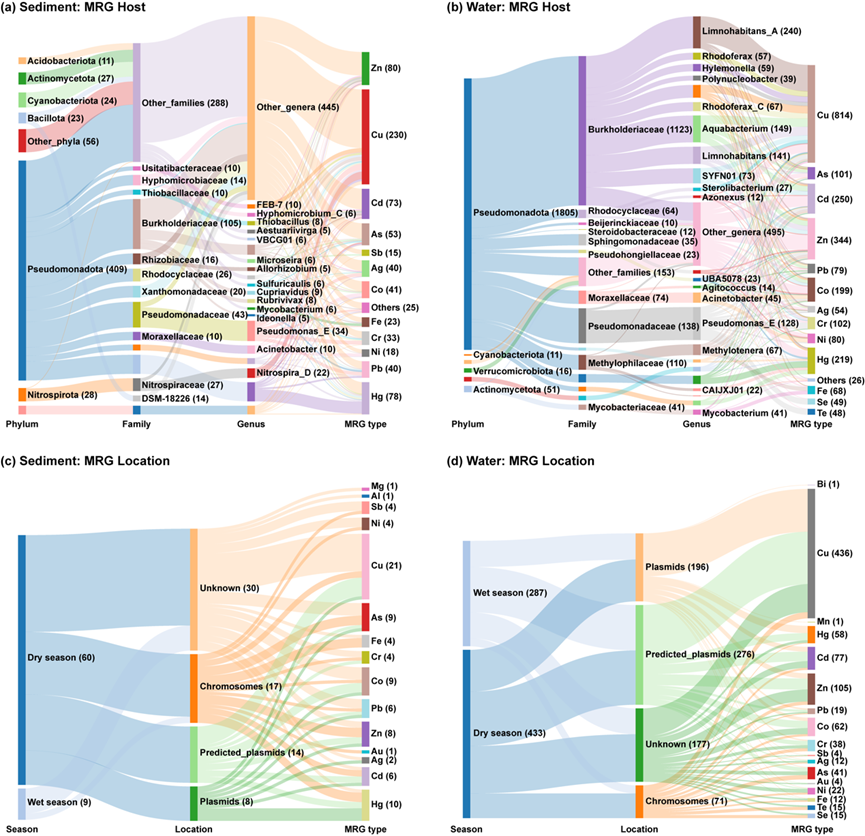
图3. 河流中MRGs的细菌宿主及其基因定位。(a) 沉积物中各MRG类型(以金属名称缩写表示)的细菌宿主。(b) 水体中各MRG类型的细菌宿主。(c) 沉积物中各MRG类型的基因定位(染色体或质粒)。(d) 水体中各MRG类型的基因定位。括号中的数值表示每个分类水平、季节、样本位置或MRG类型中所包含的contig数量。需注意,若一个contig携带两个或多个属于不同金属的MRGs,则该contig在图中会被计数两次或多次。部分分类群或MRG类型所包含的contig数量较少,已归为“others”类或未在图中显示。
水体中广泛检测到来源于质粒的MRGs
利用长度大于1000 bp的MRG-contigs预测其所在的遗传位置。在沉积物中,共有69条MRG-contigs,其中22条被鉴定为来源于质粒(图3c)。这些质粒contigs主要携带的基因包括 actP、cop、corT/coaT、czcA、mer、oscA 和 pbrA。相比之下,在水体中质粒来源的MRG-contigs占比显著更高,在720条contigs中有472条为质粒来源(图3d),而染色体来源的contigs仅占9.9%。与沉积物中情况相似,水体中质粒来源contigs也常携带 czcA、mer 和 pbrA 基因。多数 cop 基因家族的MRGs来源于质粒。值得注意的是,诸如 aioA/aoxB、pbrA、copR 和 czrA 等MRGs在染色体和质粒上均有分布。此外,chrF、copR、cop-unnamed、czcA 和 merDEPR 等基因常与MGEs共定位,提示这些抗性基因具有潜在的可迁移性和水平转移能力。
MRGs谱与ARGs谱在河流中密切相关
通过比较MRGs与ARGs的谱系相似性评估二者之间的关系。Procrustes分析表明,MRGs与ARGs谱系之间存在显著相关性,且在沉积物中表现出更强的相关性(M² = 0.72, p = 0.001),高于水体中的相关性(M² = 0.45, p = 0.001;图4a)。共现网络分析进一步验证了大量MRGs与ARGs之间存在显著相关关系(r > 0.5, p < 0.01;图4b)。沉积物中的相关基因对数及网络边数均高于水体。
网络模块化分析识别出多个MRGs与ARGs频繁共现的模块。在沉积物中,模块15包含22个MRGs和50个ARGs,其中包括5个高风险ARGs:APH(6)-Id、catB3、floR、OXA-10 和 VIM-1(图4b中高亮显示)。此外,模块2包含2个高风险ARGs(OXA-1 和 mph(A)),模块11则包含另2个(bacA 和 emrB)。在水体中,模块2由25个MRGs和21个ARGs构成,其中包括2个高风险ARGs(AAC(6’’)-Ib9 和 AAC(6’)-Ib-cr);模块4包含17个MRGs和29个ARGs,包括5个高风险ARGs:AAC(6’)-Ib11、APH(6)-Id、bacA、floR 和 VIM-1。此外,模块0和模块1中的ARGs均与多重耐药性相关。这些结果共同指示,河流环境中可能存在MRGs与ARGs之间的协同选择机制。

图4. MRGs与ARGs之间的关联分析。(a) 沉积物和水体中MRGs与ARGs之间的Procrustes分析。(b) MRGs与ARGs的相关性网络图。图中标注的节点为高风险ARGs。节点的大小表示其与更多抗性基因具有显著相关性;相同颜色的节点表示它们属于同一网络模块。(c) 携带MRGs的MAGs的基因组特征。注释中带有“U_”的分类名称表示该MAG在物种水平上尚未分类。缩写说明:As,砷;Cd,镉;Cr,铬;Cu,铜;Ni,镍;Mn,锰;Pb,铅;Fe,铁;Zn,锌;Co,钴;Ag,银;Hg,汞;Sb,锑;VFG,毒力因子基因;BRG,杀菌剂抗性基因;MLS,大环内酯-林可胺-链阳菌素类。其他抗生素名称为对应ARG类型的缩写。
河流环境中MRGs与ARGs的共定位现象罕见
在湘江流域共鉴定出2,511条MRG-contigs,其中仅有8条同时携带ARGs。其中一条contig包含一个MRG(merR)和一个ARG(tet(A)),二者位于不同的ORF位置,而其余7条contigs则具有单一ORF,编码金属和抗生素的双重抗性。这表明,在河流中,MRGs与ARGs的共定位现象较为罕见。然而,基因组组装分析显示,MRGs与ARGs可以存在于同一MAG中(图4c)。需要注意的是,MAG代表的是一组非常相似细菌的基因组信息,而非单一细胞的基因组。特别地,62.2%携带MRGs的MAGs在物种水平上未被分类,突显了河流中存在尚未表征的金属抗性细菌。
为了调查在其他河流环境中MRGs与ARGs的共定位现象是否同样罕见,分析了来自中国全国范围内河流的相关数据。在沉积物中,共检测到489条MRG-contigs和395条ARG-contigs,涉及353个样本(其中292个为公共样本,61个来自本研究;图5a)。仅有31条contigs(3.5%)同时携带MRGs和ARGs,主要由属Citrobacter(29.0%)、Leclercia(25.8%)、Enterobacter(22.6%)和Leclercia_A(9.7%)携带,这些属均属于肠杆菌科(87.1%)。在水体中,共检测到4,397条MRG-contigs和3,706条ARG-contigs,涉及687个样本(其中623个为公共样本,64个来自本研究;图5b)。仅有165条contigs(2.0%)同时携带MRGs和ARGs,分别由68个细菌物种携带,主要属Klebsiella(15.8%)、Enterobacter(12.7%)和Stenotrophomonas(10.9%)为主要宿主。这些宿主主要分布在肠杆菌科(48.5%)、Burkholderiaceae科(13.9%)和Xanthomonadaceae科(10.9%)。在全国范围的河流中,MRGs的位置(染色体来源或质粒来源)显示出与湘江流域相似的分布模式(图S5)。在沉积物中,染色体上检测到较高比例的MRG-contigs(占总contigs的31.1%)和同时携带MRGs与ARGs的contigs(占2.7%),而在水体中,质粒上检测到较高比例的MRG-contigs(占总contigs的27.6%)和同时携带MRGs与ARGs的contigs(占0.9%)。
尽管共定位现象较为罕见,但某些共定位结构由于检测频率较高,仍值得关注。在沉积物中,一些显著的共定位例子包括:汞抗性基因merRTPADE与氨基糖苷类抗性基因APH(3′′)-Ib和APH(6)-Id的共定位;锌抗性基因baeSR与多药耐药基因mdtE和大环内酯-林可酰胺-链霉素抗性基因macAB的共定位;砷抗性基因arsBC与多药耐药基因mdfA的共定位;以及砷抗性基因pstABCS和铬抗性基因yieF与多药耐药基因mdtL的共定位。在水体中,最显著的共定位结构为汞抗性mer基因家族(merRTPA),该基因与IS6家族转座酶基因、磺胺类抗性基因sul1、多药耐药基因qacΔ1以及整合酶intl1共定位。在另一条contig中,merRTPA被转座酶基因替代,且氯霉素抗性基因cmx与merBDE靠近多个转座酶和重组酶基因共定位。
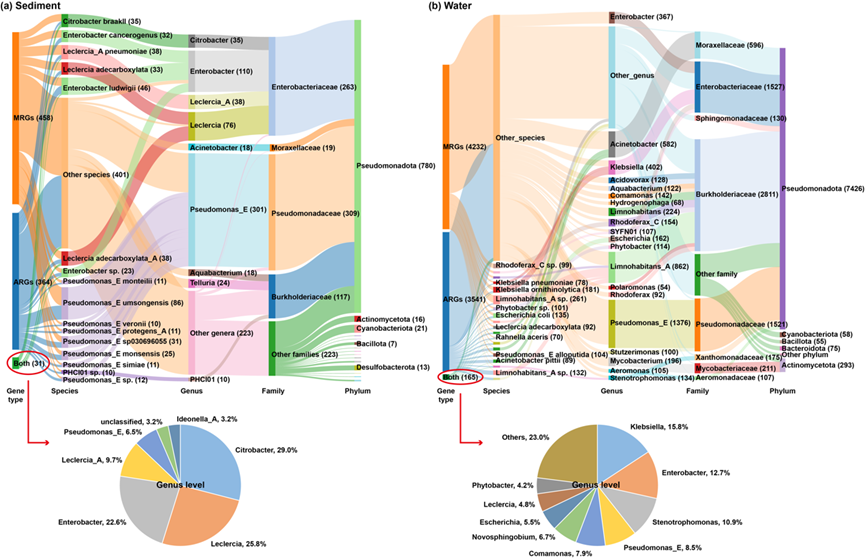
图5. 全国河流中MRGs和ARGs的宿主分布。(a) 沉积物中MRG-contigs、ARG-contigs以及MRG-ARG共定位(图中表示为“Both”)的检测情况。(b) 水体中MRG-contigs、ARG-contigs以及MRG-ARG共定位的检测情况。括号中的数值表示每个分类分支或基因类型中的contig数量。需要注意的是,如果一个contig同时携带属于两个或多个金属的MRGs,则在图中会被重复计数。某些分类分支和MRG类型的contig数量较少,因此被归入“others”或未在图中展示。图中两个饼图所示的属是沉积物或水体中MRG-ARG共定位结构的主要宿主属。
河流水体中金属抗性基因的复杂环境驱动
利用PLS-PM探讨了非生物参数和生物参数对金属抗性基因的贡献效应(图6a)。所有非生物参数对MRGs的影响较弱(p > 0.05),其中物理参数的总效应系数为0.24,营养参数为-0.10,金属参数为0.31。微生物组成对MRGs的影响较强,且为正效应(总效应系数:0.84,p < 0.001),但对微生物多样性的影响为负效应(总效应系数:-0.81,p < 0.001)。然而,微生物多样性(总效应系数:0.21)和MGEs(总效应系数:0.12)对MRGs的影响较弱(p > 0.05)。
通过分析可能来自污水和土壤来源的MRGs比例,探讨了MRGs的外部输入(图6b)。大部分沉积物中的MRGs来自土壤来源(平均值:85.3%),而仅有少量MRGs来自污水来源(平均值:7.8%)。相比之下,水体中的MRGs有更高比例来源于污水(平均值:26.4%),尽管超过一半的MRGs(平均值:69.9%)仍然来源于土壤。在水体中,污水来源对水体MRGs的贡献与MRGs的相对丰度之间存在显著的正相关线性回归关系(R² = 0.764,p < 0.001;图6c),而土壤来源对水体MRGs的贡献则表现为显著的负相关线性回归关系(R² = 0.753,p < 0.001)。然而,这一结果在沉积物中的MRGs中未能观察到(污水来源:R² = 0.002,p = 0.75;土壤来源:R² = 0,p = 0.93)。这表明,污水源对水体MRGs具有显著的驱动作用,尤其是在污染的河流段,并突显了水体比沉积物更易受外部干扰的特点。
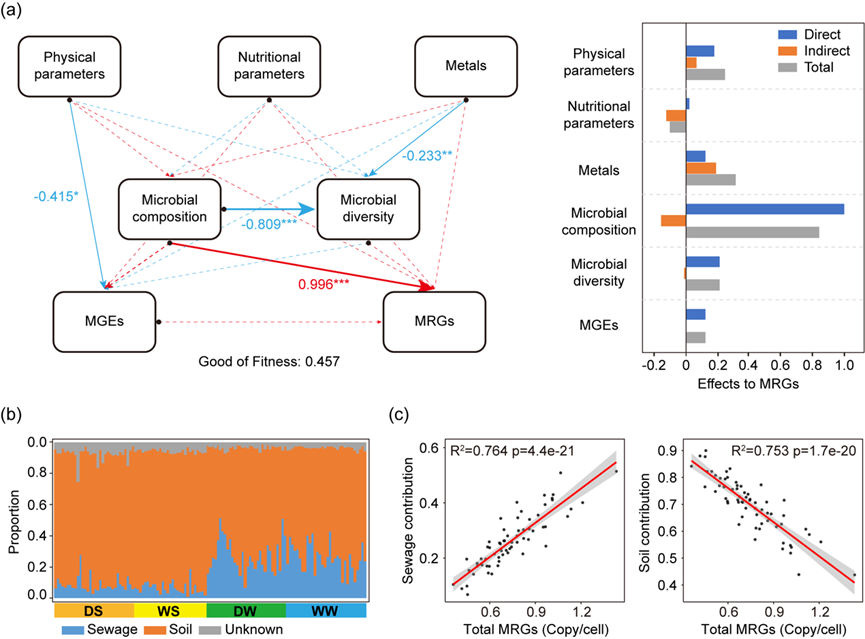
图6. 河流水体中金属抗性组的环境驱动因素。(a) PLS-PM分析环境因子(非生物和生物因子)对金属抗性组的影响。其中,理化参数包括温度、pH、溶解氧、电导率和浊度;营养参数包括氨氮、总磷、总氮和高锰酸盐指数。虚线表示不显著(p > 0.05),和*分别表示在0.01和0.001水平显著。(b) 河流中MRGs的溯源分析。(c) 河流水体中MRGs相对丰度与其来自污水或土壤源的比例之间的线性回归关系。缩写说明:MRGs,金属抗性基因;MGEs,移动基因元件;DS,枯水期沉积物;WS,丰水期沉积物;DW,枯水期水体;WW,丰水期水体。
小结
我们系统地阐述了湘江河流的重金属污染、MRGs概况及其与ARGs的关系。尽管MRGs在河流中广泛存在,但整体抗性组和特定MRGs类型或亚型的丰度与金属浓度并无显著相关性。水体中多种来源于质粒的MRGs表明,HGT在抗性基因传播中发挥了关键作用,而沉积物中大量来源于染色体的MRGs则表明抗性细菌的增殖是主要驱动因素。尽管MRGs和ARGs(包括高风险ARGs)之间的谱系存在显著相关性,但在湘江和全国河流中,MRGs与ARGs的共定位极为罕见。这强调了MRGs与ARGs的共现并非仅由抗性基因的共定位所驱动。总体而言,研究结果揭示了金属抗性组与抗生素抗性组之间的关系,为金属污染河流中的抗性共选择机制提供了新的见解。