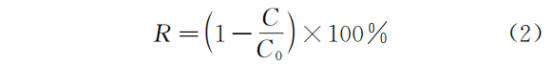唐振平:水环境微塑料中细菌的定殖规律及生态风险
微塑料(MPs)是尺寸小于5mm的塑料颗粒。水环境中的MPs易于被细菌定殖,形成生物膜,从而影响MPs的行为并造成潜在风险。考虑到MPs的广泛存在和形成生物膜的生态风险,水环境中MPs表面细菌的定殖规律及对生态系统的危害值得回顾。综述系统总结了水环境MPs表面细菌定殖的时空规律及其关键影响因素,阐述了MPs作为病原菌、耐药菌和耐药抗性基因重要储存库的潜在生态风险,最后明确了MPs污染及其风险研究的未来方向。结果表明,MPs上细菌的吸附定殖具有一定的时空分布规律,主要影响因素包括MPs的特征、定殖细菌的生理特性和外界环境因子。此外,细菌定殖于MPs会促进病原体、耐药菌、耐药抗性基因和复合污染物的传播。
引言
塑料产品因其价格低廉、重量轻、坚固耐用,在过去几十年中被广泛应用于各行各业。然而,随之产生的塑料污染和相关的生态影响已成为21世纪最突出的环境问题之一。塑料在环境暴露下可裂解为不同尺寸(粒径<5mm)的塑料碎片或颗粒,即微塑料(MPs)。MPs根据其来源大致分为2类:一种是初级MPs,主要源自于纺织品、药品、个人护理产品和研磨材料;另外一种是次级MPs,来源于经历生物和物理化学降解过程的塑料碎片。
MPs可以从土地或废水处理设施中传播到淡水环境,最终汇集至海洋。进入水生环境后的MPs能迅速被微生物定殖,形成一个与周围的基质显著不同的独特生态位——“plastisphere(塑料圈)”,导致其表面上的细菌群落不同于周围环境。2015年,Tender等率先报道了比利时北海中MPs表面的细菌群落特征。此后,研究者相继揭示了海洋、江河和湖泊等水体环境中MPs表面的细菌群落结构。环境中大多数MPs的化学特性均非常稳定,耐腐蚀且难以被微生物降解,故可以在环境中持久存在。MPs不但可以为定殖于表面的细菌提供丰富的营养物质和有机基质,还可以帮助细菌抵抗环境压力,增强细菌的扩散能力。因此,MPs被公认为当今环境中细菌的重要新兴栖息地之一。随着细菌在MPs表面定殖,MPs的特性(例如尺寸、密度和表面粗糙度)也会发生改变,这主要受定殖细菌形成的生物膜的影响。生物膜覆盖的MPs被证明对污染物的亲和力高于原始塑料。因此,MPs表面细菌定殖可能会加剧污染物传播至环境中,对生态系统构成巨大威胁。
为了获得水环境MPs中细菌定殖的研究情况,将Web of Science(WOS)核心合集数据库选为主要数据库进行了文献检索。将“ MPs” “ water environment”“bacteria”“colonization”作为关键词,检索了2013年—2023年发表的学术期刊论文,共计63篇文献。通过逐篇阅读文献,剔除与研究主题无关的内容,筛选出60篇相关文献数据。经过初步的文献分析,结果发现,水环境中细菌在MPs表面定殖与生态风险息息相关,说明了水环境MPs污染的严峻性和进行相关研究的必要性。文章主要综述了近年来水环境中细菌在MPs表面定殖的特性及衍生的环境健康效应,总结了MPs表面细菌定殖的时空分布规律及影响因素,阐明了MPs表面携带病原菌、抗生素抗性菌(ARB)和抗生素抗性基因(ARGs)的生态风险以及细菌在MPs传播复合污染物的贡献,可为开展MPs与细菌耦合性生态风险评估与控制提供参考。
规律
1.1 水环境中细菌在MPs表面定殖的空间规律
目前,研究者已借助高通量测序技术考察了不同类型水环境中MPs表面的微生物群落分布情况。大量研究证实,MPs表面的微生物群落因所处环境不同可呈现迥异的空间分布特征。首先,不同海域中MPs表面的微生物群落差异较大。例如,中国南海MPs样品中微生物操作分类单元(OTU)数目高于黄海样品水平;在中国黄海的核心属包括居冰菌(Glaciecola) (0.41% ~ 31.41%)、科尔韦尔氏菌( Colwellia ) ( 0.93% ~ 30.67%)、 赤杆菌科(Erythrobacteraceae)(0.28%~36.08%)、红杆菌科(Rhodobacteraceae)(1.92%~28.05%)和莫拉氏菌科(Moraxellaceae)的某些属(0.04%~24.32%),而在中国南海则以假交替单胞菌(Pseudoalteromonas)(0.40%~78.28%)和比齐奥氏菌(Bizionia)(0.11%~43.90%)为主。此外,同一江河不同水域中MPs表面的微生物属水平组成也不尽相同。例如,Jiang等调查了长江水系3个站点(崇明岛、吕西港和象山湾)MPs样品表面的细菌群落结构,结果发现:崇明岛水域最丰富的为 Erythrobacteraceae(10.6%)、 鞘脂单胞菌(Sphingomonadaceae)(9.5%)、丛毛单胞菌(Comamonadaceae)(8.6%)、蓝细菌(Norank _ c _ cyanobacteria) (8.1%) 和Blastocatellaceae_subgroup(7.9%);吕西港口的核心科为Rhodobacteraceae(16.4%)、Erythrobacteraceae(13.91%)、 Moraxellaceae (10.1%)、 FamilyI _ o _subsectionIII(9.6%)、植物球菌(Planococcaceae)(8.6%);而象山湾的科水平微生物则主要为Norank_ c _ cyanobacteria (22.4%)、 腐败螺旋菌( Saprospiraceae ) ( 12.5%)、 假 单 胞 菌( Pseudoalteromonadaceae ) ( 10.5%)、 黄杆菌( Flavobacteriaceae ) ( 8.5%)、 Erythrobacteraceae(8.0%)。受人类活动影响,同一海岸线不同区域的MPs样品中的细菌群落结构也截然不同。在新加坡海岸线的3 个不同类型海滩(原始、中度人口和人口稠密),原始区域丰度最高的属为短毛单胞菌(Brachymonas)(5%)、假单胞菌(Pseudomonas)(5%)和鞘氨醇单胞菌(Sphingobium)(4%);对于中度人口海岸带,最丰富的3个细菌属为弓形杆菌(Arcobacter) (6%)、 Albimonas (5%) 和拟杆菌(Bacteroides)(4%);而在人口稠密地带,其核心细菌属则包括 Erythrobacter ( 21%)、 黏聚杆菌(Cohaesibacter) ( 12%) 和詹氏生丝单胞菌(Hyphomonas)(10%)。而对于同一海岸不同深度的水体,由于温度、溶解氧、光强度和营养物质等因素的差异,MPs表面生物膜的形成和发展可能存在较大差异。研究发现,聚乙烯(PE)暴露于2m和6m深度海水处的生物膜总量明显高于12m深度,但微生物群落结构随深度变化未出现显著不同。为了更准确地认识MPs中微生物(尤其是细菌)的空间依赖性定殖规律,未来应大幅拓展研究环境介质的水平(如跨州、跨洋)与垂直(如从表层到深海)空间尺度。
1.2 水环境中细菌在MPs表面定殖的时间规律
目前已有少数研究者考察了MPs表面细菌群落的时间演替情况。首先,MPs表面细菌丰度会随时间发生改变,且变化可能会因细菌种类而异。例如,在中国南海海水中暴露了1年的聚丙烯(PP)和聚氯乙烯(PVC)MPs所附着的细菌群落中,Erythrobacteraceae、布鲁氏菌(Brucellaceae)和黄单胞菌(Xanthomonadaccae)3 个科的丰度持续富集,而科尔韦氏菌 (Colwelliaccae) 和海洋螺菌(Oceanospirillaceae)则持续降低。其次,随着时间的变化,MPs还能够改变或富集特定的核心细菌类群。例如,通过对比比斯开湾2批(2013年10月和2015年12月)MPs样品其表面的细菌群落结构,结果表明,鞘单胞菌(Sphingomonadales) 和Psychoserpens属是10月样品的生物标志物,而杆菌(Bacilli)、 黏着杆菌(Tenacibaculum)、 亮发菌(Leucothrix)、油酸杆菌(Oleibacter)和精神单胞菌(Psychomonas)是12月样品中的核心细菌属。尽管该研究中微生物群落的时间变异特性分析仅基于2次采样时间,但首次提供了MPs表面细菌群落结构随时间发生变化的初步证据。此外,附着在MPs上优势属的数量以及整体多样性会随着海水暴露时间延长而增长。MPs上优势属并不是一成不变的,特别在细菌生物膜的形成阶段,核心微生物群落随着膜的形成过程而动态变化。以PE 的MPs为例,在其生物膜形成早期(30d内),拟杆菌纲(Bacteroidia)、α-变形菌(Alphaproteobacteria)和酸微菌(Acidimicrobiia)是主要定居者;在生物膜形成的中间阶段(30~75d),优势菌落变为芽孢杆菌科(Bacillaceae)和Moraxellaceae,而PE生物膜的核心物种为Flavobacteriaceae 和Rhodobacteraceae;在生物膜形成的后期(75~135d),PE 定殖的优势细菌再次转变为Flavobacteriaceae,且与初始阶段和中间阶段相比, Rhodobacteraceae、 微 细 菌(Microtrichaceae)和Pirellulaceae明显增加。最后,MPs附着微生物群落的结构和组成会因季节而异。与春季(4月)和冬季(11月)相比,中国珠江三角洲夏季(6月)MPs表面微生物群落的多样性有所下降。
影响因素
2.1 MPs的特性
MPs的特征主要包括类型、浓度、形貌和表面粗糙度(表1)。
表1 MPs 特征对细菌定殖的影响
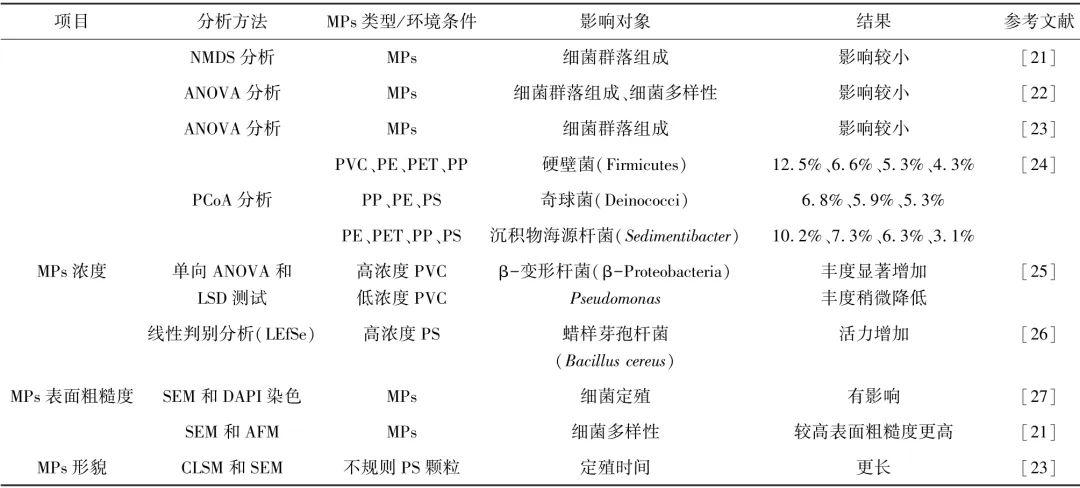
注:PERMANOVA为置换多元(因素)方差分析;PCoA为主坐标分析;NMDS为非度量多维标度分析法;ANOVA为方差分析;CSD为直线段检测算法;CLSM为激光扫描共聚焦显微镜;SEM为扫描电子显微镜;DAPI为4,6-联脒-2-苯基吲哚;AFM为原子力显微镜。
目前,MPs类型对细菌群落的影响尚存争议。大部分研究表明,不同类型的MPs可能由于塑料特性的差异(例如,作为定殖位点的表面积和疏水性)为微生物群提供不同的生态位,对水环境细菌在MPs上的吸附和定殖的影响会显著不同。也有研究认为,MPs类型对表面细菌群落的多样性和相对丰度影响较小。例如,MPs类型对其表面细菌群落的多样性和相对丰度影响较小。类似地,Li等也证实,在相同的暴露时间下,5种MPs[PVC、PP、PE、聚苯乙烯(PS)和聚氨酯]的Chao1指数(p>0.05)无显著差异。造成这类现象的主要原因是,与地理因素和基质的影响相比,MPs自身理化性质(如化学成分)差异对细菌群落的结构影响较小。此外,暴露试验研究进一步表明,MPs对其表面细菌群落的影响不仅取决于MPs的类型,还取决于MPs浓度。Li等使用16S rRNA测序技术检测了暴露于湖水中的不同浓度PE MPs表面的细菌群落。研究发现,20 mg/L PE组的变化比2 mg/L PE组更显著抑制Bacteroidia和Blastocatellia的丰度(p<0.05)。Wang等还发现,暴露于城市水体中较高浓度的MPs可促进优势类群的富集,如γ-变形菌纲(Gammaproteobacteria)。此外,MPs形貌特性也被证实为影响细菌粘附的重要理化因素之一。Hossain等发现,MPs(PE、PP 和PS)在暴露于湖水中长达8周后,其表面细菌[塞帕奇伯克霍尔德氏菌( Burkholderia cepaci)、 大肠杆菌(Escherichia coli)]丰度会随着MPs粗糙度提高而增加。类似地,3种MPs(PE、PP 和PS)暴露于波罗的海水2周后,其表面细菌群落的多样性与MPs的粗糙度呈正相关,且不规则PS MPs较光滑球形MPs可为短链弧菌(Vibrio crassostreae)提供更长的定殖时间周期。然而,Hook等结合原子力显微镜(AFM)、飞行时间二次离子质谱、水接触角表征分析认为,形貌(或粗糙度)不会显著影响细菌对聚合物基质的附着。
对于上述MPs自身理化性质对不同类型细菌定殖影响的不一致结论,其根源可能在于细菌黏附于MPs表面的行为还受细菌细胞生理特性(如细菌表面疏水性)的影响。同时,MPs的尺寸、Zeta电位和结晶度/刚度等表面特性也会影响其与细菌相互作用。
2.2 细菌生理结构与特性
细菌已经衍生出与MPs底物相互作用的多种生理适应策略。目前,细菌定殖MPs的生理性作用主要借助表面结构和胞外聚合物(EPS)调节其表面电荷和疏水性实现。细菌细胞的鞭毛、性菌毛和菌丝等胞外细胞器可以调节细胞壁和细胞膜的表面电荷和疏水性,提高细胞克服静电斥力的能力。因此,细菌胞外细胞器可能能够促使细菌初步黏附于MPs表面。扫描电子显微镜观察证实,Vibrio crassostreae J2-9可通过菌毛等特定结构附着在6 μm光滑球形PS MPs上,而Escherichia coli细胞也能通过鞭毛直接黏附在5 μm PS微珠表。此外,当MPs孵育8周后,在其表面定殖的带鞭毛结构的Burkholderia cepaci和Escherichia coli高于缺乏鞭毛结构的醋酸钙不动杆菌(Acinetobacter calcoaceticus)丰度。然而,上述研究并未能提供菌毛、鞭毛等胞外细胞器介导细菌黏附MPs表面的直接证据。
静电引力被认为是细菌细胞和MPs界面相互黏附过程中最先产生的相互作用。例如,一些具有较高表面自由能的致病性Escherichia coli和粪肠球菌(Enterococcus faecalis)在疏水性MPs表面的黏附力较弱,具有较低的表面自由能的鼠伤寒沙门(氏)菌(Salmonella typhimurium) 和恶臭假单胞菌(Pseudomonas putida)却可优先附着在疏水性更强的表面上。
EPS在细菌定殖于MPs表面过程中也起着关键作用。一方面,EPS可以使MPs更黏,将微生物群落结合在一起。另一方面,EPS可以特异性地控制微生物的理化性质,保护细胞免受外部环境的影响和有毒物质的伤害。例如, 嗜碱盐单胞菌(Halomonasalkaliphila)经NH2改性1 μm PS处理后EPS分泌量较少;但纳米(55 nm PS)塑料处理2h后,EPS(尤其是多糖)显著升高。遗憾的是,研究无法确定EPS的存在与MPs表面细菌聚集的因果关联。同时,EPS在细菌与MPs 互作过程中的动态贡献及其内在调节机制有待进一步明确。
2.3 外界环境因素
影响MPs上细菌的吸附定殖的环境因子有盐度、温度、抗生素、营养基质、紫外线、表面活性剂和多氯联苯等。首先,基于NMDS分析、典型关联分析(CCA)、PCoA和冗余分析(RDA),盐度已被证实为影响海洋细菌组分的最重要因素之一。其次,研究基于NMDS、CCA和PCoA等相关性分析证明,温度会显著影响海洋MPs表面细菌定殖。再者,营养基质(有机物)可影响细菌群落在MPs表面的定殖能力,尤其是低营养水平更能促进细菌附着于MPs表面,但目前仍缺乏相关的试验证据。最后,MPs表面吸附的抗生素和多氯联苯等化学物质也被证明会显著改变MPs表面的细菌组成。河口和海水中PE MPs表面吸附的抗生素不仅会使其表面微生物多样性下降,还导致部分脆弱属[如噬甲基菌(Methylophaga)、 海泥杆菌(Lutimaribacter)、栖东海菌(Donghicola)、耐盐深海球菌(Thalassococcus)和鲁杰氏菌(Ruegeria)]彻底消失,而PVC MPs表面吸附的多氯联苯虽未显著影响其表面生物膜的群落组成,但明显诱使有机卤化物呼吸成员脱卤球菌(Dehalococcoidia) 的富集。
需要指出的是,以上研究结论多基于相关性分析,缺少不同环境因子作用下MPs的暴露试验验证,因此其作用机制尚不明确。一项研究发现,低密度PE MPs经紫外线预处理后,其表面的肠杆菌(Enterobacteriaceae)细菌比例显著提升(占细菌总数的75.3%),而Flavobacteriaceae和布鲁氏杆菌(Bruellaceae)比例大幅下降;当PE MPs添加了表面活性剂后,导致Moraxellaceae的丰度增加。研究推测,紫外线预处理导致MPs表面变得更粗糙、多孔,甚至出现裂纹与沟槽,降低其疏水性(接触角),有利于微生物黏附和生物膜的形成;而表面活性剂的存在降低了PE MPs表面的疏水性,从而促进了微生物与MPs之间的接触。该研究为环境因子对细菌定殖于MPs的影响机制提供了初步解释,同时也为后续研究提供了思路(即环境因子通过改变MPs理化性质或细菌生理特性而影响二者的相互作用)。
生态风险
3.1 MPs 携带的病原菌
MPs表面定殖的病原菌等细菌会随着MPs迁移进入非栖息地(如鱼类等海洋生物体内)。目前已经在水环境中MPs上检测到许多Vibrio、Pseudomonas、不动细菌(Acinetobacter)等致病物种,其中Vibrio是报道得最多的潜在病原菌。Zettler等先驱性的研究报告显示,在北大西洋收集的PP颗粒上Vibrio占其总细菌群落比例高达24%。类似地,Kirstein等的研究证实13%的海洋MPs颗粒检出可培养Vibrio,其中12个MPs颗粒上检测到潜在致病性副溶血性Vibrio。MPs表面的化学结构、类型会影响微生物病原菌在MPs表面的定殖。目前多数研究认为,MPs可富集丰富多样的病原菌。在湖水中低密度PE MPs表面生物膜内丰度最高的20个细菌种属中有1/2是潜在病原体,包括丛毛单胞菌(Comamonas)、 土壤杆菌(Agrobacterium)、 短波单胞菌(Brevundimonas)、Acinetobacter、鞘氨醇杆菌(Sphingobacterium)、法氏沃氏菌(Wautersiella)、金黄杆菌(Chryseobacterium)、芽孢杆菌(Bacillus)和巴氏梭菌(Clostridium)等。类似地,河水中MPs表面霍乱弧菌(Vibrio cholerae)与金黄色酿脓葡萄球菌(Staphylococcus aureus)、港湾源水接种的MPs表面脓肿分枝杆菌(Mycobacterium abscessus)、巨大芽孢杆菌(Bacillus megaterium)和浅黄分枝杆菌(Mycobacterium gilvum)的相对丰度明显高于其水域其他环境。
上述研究证实了MPs是病原菌的重要载体。与许多非漂浮颗粒或短时间降解的颗粒相比,MPs表面潜在的病原体具有更长的停留时间和可运输性。从长远来看,MPs可能成为病原体在环境中重要的传播媒介。塑料圈中潜在病原菌的生长和扩散动态及其对人体暴露的健康风险评估与控制仍待进一步研究。此外,MPs与肠道微生物组关联的病原菌研究之间的相互作用模式也有待研究。
3.2 MPs 携带的ARGs 和ARB
目前,MPs已被证实可作为水环境中ARGs和ARB的重要载体。首先,MPs表面可富集高丰度的ARGs。在北太平洋中,MPs中总ARGs的平均相对丰度[5.15 × 10-3copies/(16S rRNA gene copies)]可达到海水中ARGs丰度[9.36 × 10-4 copies/(16S rRNA gene copies)]的5.69倍。此外,在海产养殖系统中MPs表面多抗生素抗性细菌(MARB)中,ARGs的阳性检出率高达80.0%,而水样品中ARGs的阳性检出率为65.3%;同时,MPs表面分离物MARB中绝大部分(84.6%)ARGs(包括磺酰胺、四环素、β-内酰胺、氨基糖苷和大环内酯等类型抗性基因)的阳性检出率比周围水样品高1.7%~25%。其次,MPs可以选择性富集不同类型ARGs。中国浙江嘉兴的城市化河流中MPs 会选择性富集tetM、tetS 和tetW 等亚类ARGs。以南京某湖泊为水样进行试验研究表明,iARGs(即itetA、i-tetC、i-tetO、i-sul1)、整合子整合酶基因(intI1)和eARGs(即e-tetA和e-blaTEM)在MPs上选择性富集。最后,MPs携带着独特ARGs。与天然基质(岩石和叶片)相比,MPs表面孵育的生物膜具有多种独特的ARGs:多重耐药基因smeE和mdsC;氟喹诺酮抗性基因qnrVC6;链脲菌素大环内酯抗性基因ermF、lnuE;β-内酰胺抗性基因blaVEB-9;氨基糖苷抗性基因aadA13、APH(9)-Ia、APH(3″)-VI、aadA16;磷霉素抗性基因fosK;利福平耐药基因arr-5;氯霉素抗性基因cmx;甲氧苄啶抗性基因dfrA15。
MPs是ARB和超级细菌的有效载体,可促进ARGs在环境中的传播。例如,从海洋塑料中分离并检测出多重耐药菌株B.toyonensis。在海水养殖系统中MPs表面的ARB含量比水样品中MPs表面的ARB含量高100~5 000倍;在MPs样品中,对多重抗生素(青霉素、磺胺呋喃唑、红霉素和四环素)具有抗性的MARB分离物所占比例更高。Radisic等发现,海洋MPs不仅携带潜在的强毒鱼类病原体和多药耐药的机会性人类病原体,例如摩根(氏)菌(Morganella morganii),并且可以作为在海洋环境中运输这些病原体的媒介。不过,也有少数研究表明,MPs在介导特定类型ARB的传播作用较小。经过13~79d的河水或海水孵育后,4个具有不同盐度水平位点中高密度PE和磨损轮胎颗粒均未发现Escherichia coli;相反,在位点水域中都检出产生超广谱β-内酰胺酶Escherichia coli,其中64%赋予了多重抗性。这表明,由MPs 介导的产生超广谱β-内酰胺酶Escherichia coli的传播可能性很小,但并不能忽视MPs作为多重耐药细菌载体的作用。因此,在未来研究中,除了拓展塑料圈中耐药风险的时空研究范围外,还应着重关注MPs对于高风险ARB(如MARB、黏菌素抗性菌)传播的影响。
3.3 细菌在MPs传播复合污染物的作用
MPs与复合污染物(如重金属和有机物)之间的相互作用可能会受到细菌(尤其是细菌生物膜)的影响。一方面是因为细菌自身及其EPS具有吸附MPs复合污染物的能力,另一方面细菌能够代谢降解部分MPs复合污染物。少数研究报道了生物膜能够强化MPs对重金属和抗生素的吸附作用。Richard等基于多变量分析表明,生物膜可促进河口水中Cu、Pb、Al、K、U、Co、Mg和Mn等金属吸附于MPs上。此外,Johansen等基于光谱学、显微镜和放射性示踪剂方法发现,生物膜可增强MPs对放射性重金属Cs 和Sr的吸附能力:非风化、非生物膜PP MPs 对Cs和Sr的吸附量为表面覆盖风化生物膜的MPs对Cs和Sr吸附量的1.0%~1.6%。再者,生物膜还被证实能够改变四环素和Cu在PE MPs上的吸附行为:与原始MPs相比,具有生物膜的MPs可通过生物膜组分的络合作用和膜扩散作用吸附更多的四环素和Cu。因此,未来的研究应进一步聚焦于MPs 表面微生物群落组成和不同类型细菌如何促进多种复合污染物吸附到MPs上。
结论与展望
文章综述总结了水环境中MPs表面细菌的定殖规律及对生态系统的危害,结论与展望主要包括以下内容。
(1)不同时空中水环境MPs上细菌的定殖特征存在差异。未来应重点拓展MPs研究区域跨度(如跨州、跨洋)与垂直空间尺度(如从表层到深海)。
(2)影响细菌定殖的主要因素包括MPs特征、外界环境因子和定殖细菌的生理特性3大方面,未来研究应综合多种新型表征手段和生物信息学全面区分考察MPs理化性质在复杂的细菌黏附过程的贡献,以进一步研究MPs特性对细菌定殖的影响。
(3)MPs携带着病原菌、ARGs 和ARB,还能吸附并传播重金属和抗生素等污染物,从而对人类健康构成潜在威胁。仍应进一步探究细菌群落如何促进多重复合污染物吸附到MPs上。此外,不同类型细菌对于MPs与复合污染物相互作用的影响也将成为未来研究的重要内容之一。