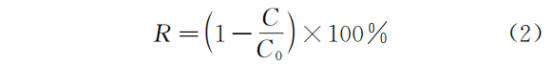不同消毒方式下的微生物群落组成及对管段腐蚀的影响
导读:因腐蚀引起的管网问题和多元化的消毒方式选择越发受到关注。文中针对不同消毒方式下生物膜中的优势菌群在腐蚀过程中发挥着的作用展开了试验研究,通过高通量测序对中试管网系统各管段中生物膜细菌群落特征进行表征,并进行深入分析。研究结果表明,在紫外消毒方式下,生丝微菌属(Hyphomicrobium)是其优势菌属,属于反硝化菌,对管段的腐蚀有抑制作用。氯消毒方式下,丙酸弧菌属(Propionivibrio)是主要优势菌属,在一定程度上会促进金属点蚀的形成。在紫外-氯消毒方式下,管段运行初期,多数菌属与紫外消毒方式下初期的微生物群落组成相近,反硝化菌属作用明显,但随着管段运行的时长增加,Propionivibrio变为主要优势菌属。由此,认为采用紫外或紫外-氯消毒方式对管段腐蚀起到一定的抑制作用。
1 试验材料与方法
1.1试验装置
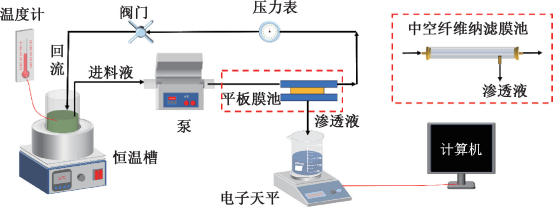
紫外-氯联合消毒管网试验装置采用手动方式控制系统开关、进水蠕动泵流量、加药泵的泵速调节及紫外设备的开启。该套试验装置搭建于某水厂的中试基地内,其中紫外设备连接在中试基地的水箱后。水箱的水为水厂的炭池出水。紫外设备选用特洁安PRO10(低压汞灯),紫外剂量为40mJ/cm2。管网试验装置的进水流量为0.7 m3/h,管段均为无内防腐的1 m长DN50铸铁管段,所加的消毒剂为次氯酸钠溶液质量浓度为0.3~0.7mg/L。试验期间原水水温处于4.4~26.8 ℃,pH值在7.2~8.1,浑浊度不高于0.2NTU,试验装置的工艺流程如图1所示。
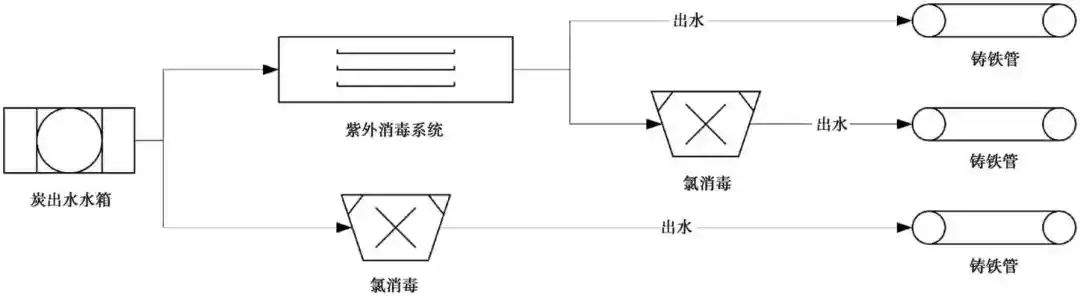
图1 中试系统的工艺流程
1.2管壁微生物样品的采集及处理
在试验系统稳定运行4、10 个月和15 个月时,将管段拆卸下来进行管壁微生物样品的采集。管内壁微生物使用无菌棉签蘸取后直接放入无菌容器内并做好标记。所有管内壁微生物样品立即冷冻保存,并在24 h内将样品送往上海美吉生物医药科技有限公司进行高通量测序。
1.3试验样品的测定方法-高通量测序
管壁微生物样品在-80℃条件下进行高通量测序。本测试选用16S RNA功能基因的V3-V4 双可变区段产物进行聚合酶链式反应(PCR)扩增测序,所选引物为分别是338F(5′-ACTCCTACGGGAG GCAGCA-3′)和806R(5′-GGACTACHVGGGTWTC TAAT-3′),而后通过QIIME、Mothur等软件对测序数据进行分析。
1.4测序结果的分析方法
经过Mothur软件去除低质量序列等一系列处理后,而后利用Mothur软件中的make.group命令生成groups格式文件;dist.seqs 命令生成距离矩阵;cluster 命令进行聚类分析;bin.seqs命令输出分类操作单元(OTU);get.oturep命令得到代表性OTU,并计算OTU个数及OTU所属水样;make.shared命令生成OTU table;classify.seqs命令将序列与sliva数据库的高质量序列比对,得出分类结果。序列比对同源性大于97%的认为属于同一OTU;相似性小于97%可认为属于不同的种,相似性小于93%,可认为属于不同的属。根据分类学分析结果,可以得知样品中有何种微生物和它们各自含有的序列数,并计算微生物分别在门、纲、目、科、属水平上所占的相对百分含量。
微生物群落α多样性指数分析,主要是针对菌属丰度指数和菌属多样性指数两方面进行分析。菌属丰度指数常用基于丰度的覆盖估计值(ACE)和Chao来表征,数值越大代表OTU数目越多,说明样本中包括的物种数目越多。菌群多样性指数常用辛普森多样性指数(Simpson′s diversity index)和香农多样性指数(Shannon′s diversity index) 表 征。Simpson指数越大,说明群落微生物多样性越低,每个菌分布的均匀度越低;Shannon 指数越大,说明群落微生物多样性越高,每个菌分布的均匀度越高。
2 试验结果与分析
2.1供水管段管壁微生物样品丰度及多样性变化
本试验采用以上所提及的指数来描述生物膜中的微生物群落α多样性,根据表1~表3对比分析不同消毒方式下的管壁微生物群落丰度及多样性的变化。
表1 紫外消毒方式下微生物群落丰度及多样性指数
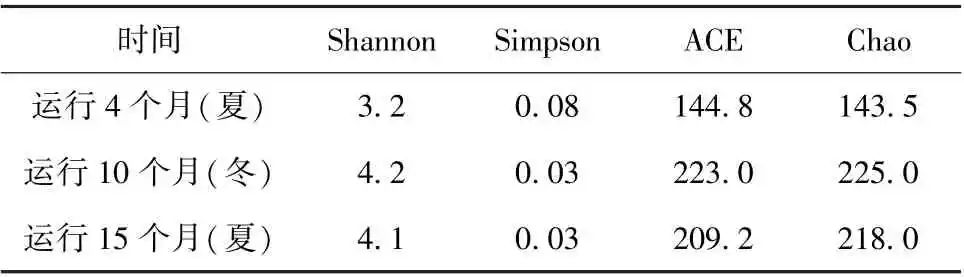
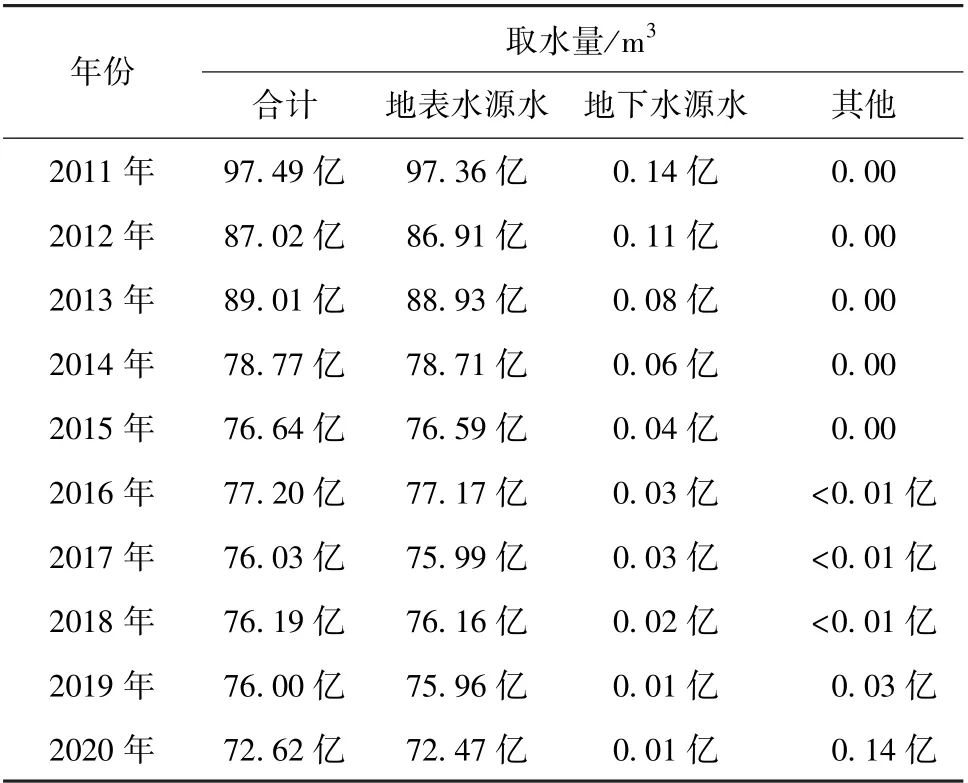
由表1紫外消毒方式下管壁微生物群落的丰度及多样性指数在不同的运行阶段可知,运行15个月后,Shannon 指数约为4.1,菌群丰度指数Chao 约为218.0。管段运行的前10个月中,管段中的管壁微生物菌群丰度指数升高明显,同时表征生物多样性的Shannon 指数也有明显的变化。
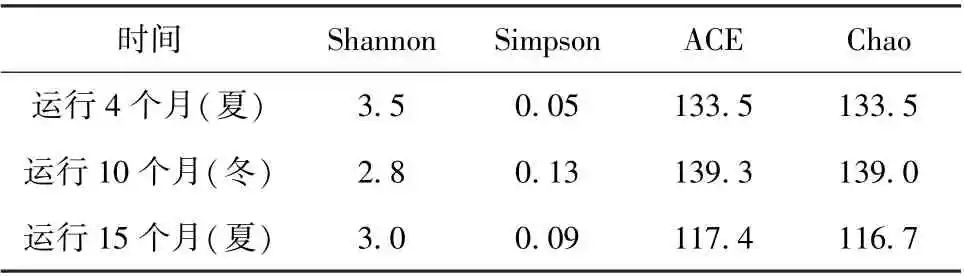
由表2 紫外-氯消毒方式下管壁微生物群落的丰度及多样性指数在不同的运行阶段可知,运行15个月后,Shannon指数约为3.0,菌群丰度指数Chao约为116.7,与紫外消毒方式下的管壁微生物菌群丰度指数与多样性指数相比明显较低。
表2 紫外-氯消毒方式下微生物群落丰度及多样性指数
由表3氯消毒方式下管壁微生物群落的丰度及多样性指数在不同的运行阶段可知,运行15个月后,Shannon指数约为1.8,菌群丰度指数Chao约为120.3。管段运行的前10个月中,管段中的管壁微生物菌群丰度指数升高明显,同时表征生物多样性的Shannon指数也明显升高,与紫外-氯消毒方式相比,后者具有更高的生物多样性指数,但菌群丰度指数相差不明显。
表3 氯消毒方式下微生物群落丰度及多样性指数
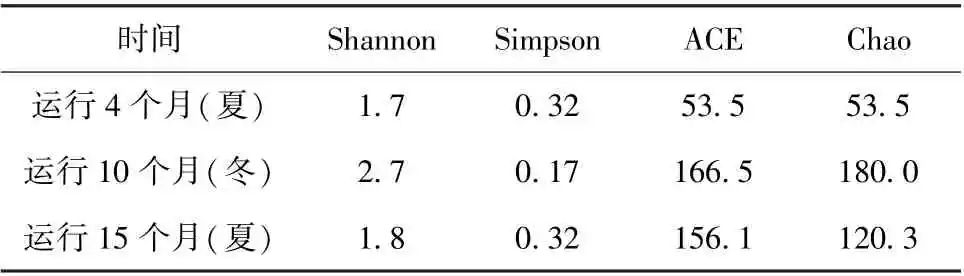
对比3种消毒方式下管壁微生物群落的丰度及多样性指数,紫外消毒方式下的管壁微生物群落的菌属数目更多且每一菌属的均匀度更高。
2.2供水管段管壁微生物的群落组成
在中试试验运行过程中,在中试系统运行4、10、15个月时,分别对不同消毒方式下运行的管段的管壁生物膜在属水平的群落结构组成情况进行对比分析,如图2~图4所示。
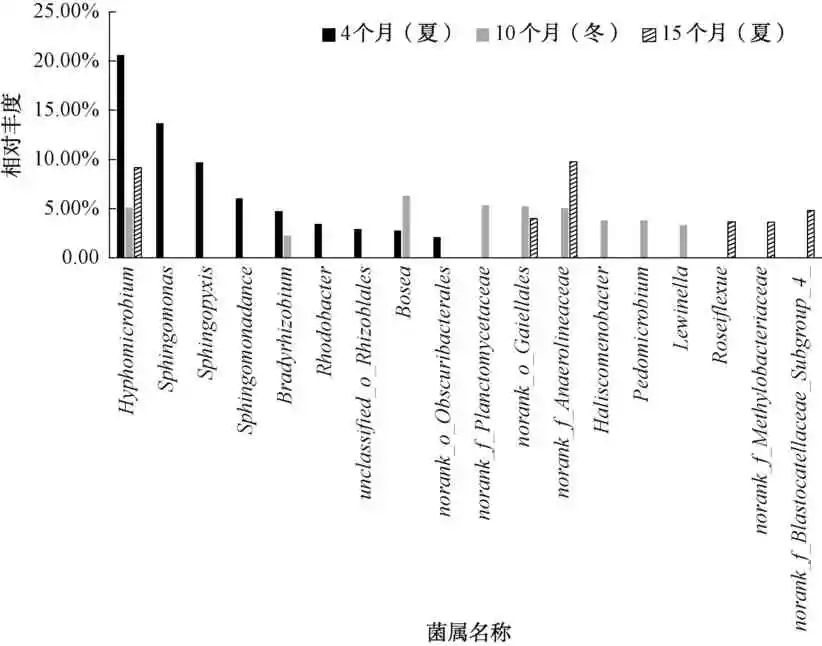
图2 紫外消毒方式下的生物膜中的微生物在属水平上的微生物群落分布
图2在属水平上比较了紫外消毒方式下在不同运行阶段中生物膜的细菌丰度,在管段运行的不同阶段,生物膜上的微生物在属水平的差异很大。在管段运行的不同 阶段,生丝微菌属(Hyphomicrobium)的相对丰度较高,运行4个月时相对丰度为20.59%,运行10个月时相对丰度为5.14%,运行15个月时相对丰度为9.16%,是紫外消毒方式下的主要优势菌属。Hyphomicrobium 属于反硝化细菌,参与管段中的铁循环。研究表明,反硝化菌参与Fe-N循环抑制腐蚀。在管段运行4个月时,生物中的主要菌属中鞘脂单胞菌(Sphingopyxis) 为 9.71%、 Sphingomonadaceae 为6.02%、慢生根瘤菌属(Bradyrhi-zobium)为4.71%和红杆菌属(Rhodobacter)为 3.45%。其中,Bradyrhizobium均具有分泌铁载体的功能,参与管段中的铁循环。同时,Rhodobacter属于铁还原菌。一般认为,管段中的铁还原菌对管段腐蚀有抑制作用,而管段中的铁氧化菌对管段腐蚀则有促进作用。由此看出,在管段最初运行阶段,紫外消毒方式下生物膜中的主要菌属基本都与管段中的铁循环反应有关,说明微生物对管段的腐蚀具有重要的影响。待管段继续稳定运行半年后,生物膜中的主要菌属博斯氏菌属(Bosea)为6.28%、浮霉菌属(norank_f_Planctomycetaceae)为5.32%、盖勒氏菌属(norank_o_Gaiellales)为5.22%、厌氧绳菌属(norank_f_Anaerolineaceae) 为5.05%、Haliscomenobacter 为3.83%、土微菌属(Pedomicro-bium)为3.81%以及赖文氏菌属(Lewinella)为3.32%。其中Pedomicrobium和Bradyrhizobium的作用基本相同,具有分泌铁载体的功能。研究表明,Anaero-lineaceae是一种典型的反硝化细菌,该菌属多与微生物死亡后细胞残体降解相关,同时,对有机物有一定的降解作用,Planctomycetaceae是一类厌氧氨氧化菌,具有硝化反应的特征,也具有反硝化反应的特征。待管段运行周期达到15个月时,玫瑰弯菌属(Roseiflexue)为3.67%、norank_o_Gaiellales为3.99%、甲基杆菌属(norank_f_Methylobacteriaceae)为3.65%、norank_f_Blastocatellaceae_Subgroup为4.83%、 norank _ f _Anaerolineaceae 为9.75%。由此看出,管段运行的不同阶段中,具有反硝化功能的菌属为紫外消毒方式下的主要优势菌属。
图3在属水平上比较了紫外-氯消毒方式下在不同运行阶段中生物膜的细菌丰度,在管段运行的不同阶段,生物膜上的微生物在属水平上存在很大的差异。在管段运行的最初4个月,生物膜中的主要优势菌属鞘氨醇单胞菌(Sphingomonas)为13.55%、Rhodobacter为8.13%、 鞘 脂 单 胞 菌 属(Sphingopyxis)为7.73%、 unclassified _ f _ Comamonadaceae 为6.92%、Hyphomicrobium为6.73%、芽单胞菌属(Blastomonas)为5.19%、Methyloversatilis为4.98%、 Bosea为4.88%、 短波单胞菌(Brevundimonas) 为 3.48%和Undibacterium为3.24%,其中unclassified_f_Comamonadaceae是一种典型的反硝化细菌。Sphingomonas和Sphingopyxis均具有分泌铁载体的功能,可以与铁离子形成稳定的螯合物,在腐蚀产物表面形成保护层抑制铁释放。同时,Rhodobacter属于铁还原菌,与铁之间作用可以促进铁氧化物的沉积形成Fe3O4,进而更好地抑制腐蚀。随着管段运行时间的变化,生物膜中的菌属变化极其明显。当管段运行10个月时,生物膜中的主要优势菌属Bosea为15.22%、Undibacterium为24.18%、丙酸弧菌属(Propionivibrio)为17.73%、红球菌属(Rhodococcus)为11.06% 和乳杆菌属(Lactobacillus)为6.29%。其中Rhodococcus是一种好氧反硝化菌,Propionivibrio及Lactobacillus属于产酸菌,产酸细菌在生长过程中会分泌有机酸,这种有机酸会促进金属的点蚀。当管段运行达15个月时, Propionivibrio为 17.31%、 Phreatobacter为17.16%、脱氯单胞菌属(Dechloromonas)为9.87%、Pseudomonas为5.4%、norank_o_Obscuribacterales为4.48%和超磁细菌(Magnetospirillum)为4.46%。其中,Magnetospirillum在铁氧化物转化中起到很重要的作用,与形成Fe3O4有关。由此看出,管段运行的不同阶段中,具有反硝化功能的菌属成为优势菌属,主要与紫外参与消毒有关。同时,产酸菌在运行时期相对较长时,逐渐成为另一优势菌属,这与氯消毒剂参与反应有关。
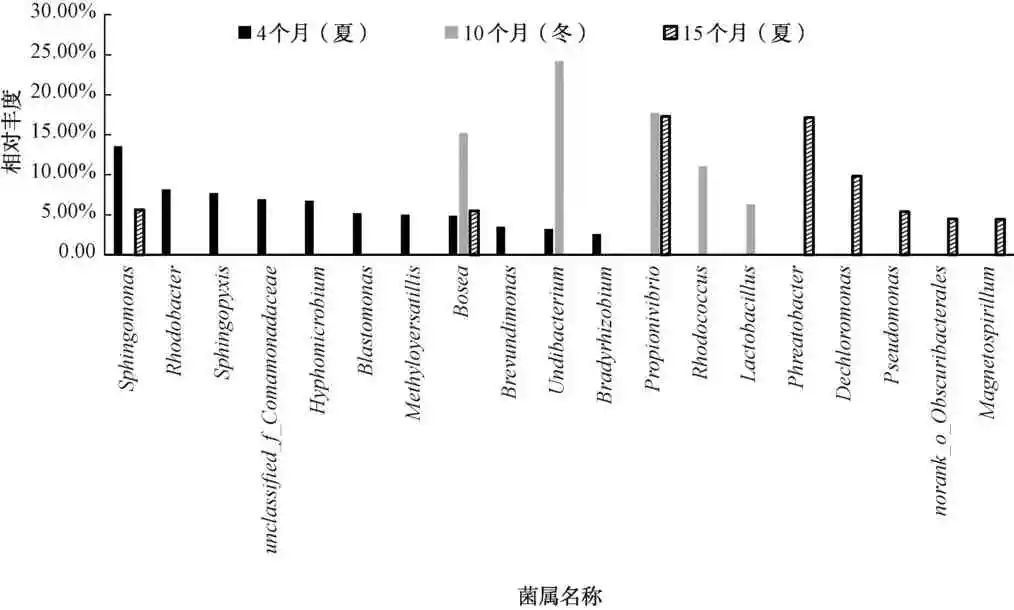
图3 紫外-氯消毒方式下的生物膜中的微生物在属水平上的微生物群落分布
图3、图4在属水平上比较了氯消毒方式下在不同运行阶段中生物膜的细菌丰度,在管段运行的不同阶段,生物膜上的微生物在属水平上存在很大的差异。在管段运行的不同阶段,Propionivibrio的相对丰度较高,运行4个月时相对丰度为51.73%,运行10个月时相对丰度为33.64%,运行15个月时相对丰度为53.29%,是氯消毒方式下的主要优势菌属。该菌种是一种产酸菌,会促进金属的点蚀,因而在管段中形成的管垢基本是点状为主。管段运行4个月时,主要的菌属Blastomonas为19.5%、食酸菌属(Acidovorax) 为 8.6% 和Phreatobacter为4.93%,其中,Acidovorax的生长能够产生羟基醋酸,导致酸性环境的形成从而对腐蚀产生促进作用。同时,该菌属也属于铁氧化菌,在氧化二价铁的过程中直接产生α-FeOOH。因而,在管段运行的初始阶段,较大比例的产酸菌出现在管段中,会促进金属的点蚀。管段运行10 个月时,主要的菌属芽孢杆菌属(Bacillus) 为20.69%、 Rhodococcus为7.57%、Undibacterium为3.01%。其中,Bacillus不仅含有可以产生孢子的微生物,还能够影响管道的电化学腐蚀过程,继而影响腐蚀产物的形成。待管段稳定运行达到15个月时,主要菌属Bradyrhizobium为11.29%、 沉积小杆菌属(Sediminibacterium)为6.78%、norank _ o _ Obscuribacterales为6.03%和Unclassified _ o _ Rhizobiaceae为 3.62%。其中,Sediminibacterium是一种铁氧化菌,它通常对管段腐蚀有促进作用。由此看出,氯消毒方式下管段中的主要菌属对管垢的形成起到促进作用。
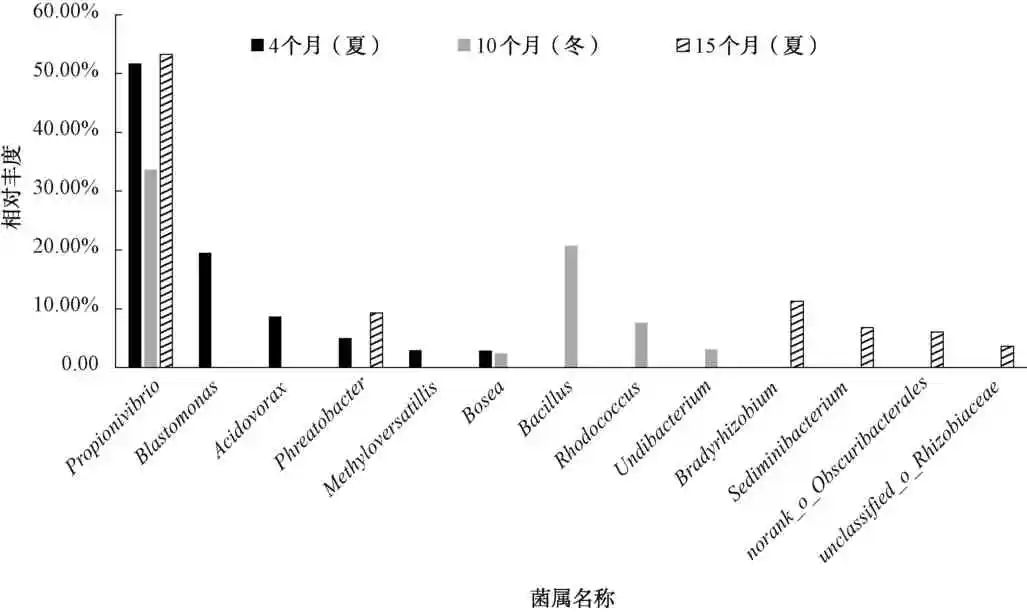
图4 氯消毒方式下的生物膜中的微生物在属水平上的微生物群落分布
对比3种消毒方式下的管壁微生物群落的组成可看出:紫外消毒方式下,Hyphomicrobium的相对丰度在不同的运行阶段均保持较高的丰度,它可参与Fe-N循环,起到抑制腐蚀的作用;氯消毒方式下,Propionivibrio的相对丰度在不同的运行阶段均保持较高的丰度,它可以促进金属的点蚀,起到促进腐蚀的作用;而紫外-氯消毒方式下,在管段运行初期,多数菌属与紫外消毒方式下初期的微生物群落组成相近,但随着管段运行的时长增加,Propionivibrio占据较高的丰度,主要是氯消毒剂的作用逐渐突显导致。由此可认为,采用紫外和紫外-氯消毒方式可以对管网的腐蚀起到一定的抑制作用。
3 结语
(1)紫外消毒方式下,在管段运行的不同阶段,Hyphomicrobium 的相对丰度较高,是紫外消毒方式下的主要优势菌属,属于反硝化细菌,参与管段中的铁循环,反硝化菌参与Fe-N循环抑制腐蚀。
(2)紫外-氯消毒方式下,管段运行的最初阶段,具有反硝化功能的菌属为优势菌属,随着管段运行时间的变化,生物膜中的菌属变化极其明显,产酸菌逐渐成为另一优势菌属,这与氯消毒剂参与反应有关。产酸细菌在生长过程中会分泌有机酸,这种有机酸会促进金属的点蚀。
(3)氯消毒方式下,在管段运行的不同阶段,Propionivibrio 的相对丰度较,是氯消毒方式下的主要优势菌属。该菌种是一种产酸菌,会促进金属的点蚀,因而在管段中形成的管垢基本是点状为主。而且,在管段运行初期较大比例的产酸菌出现在管段中,对管垢的形成起到促进作用。