磷酸铁锂从灰分回收磷/铁与盐湖/海淡卤水提取锂合成
编者按:磷酸铁锂(LiFePO4)乃新型电池重要原料。然而,无论是元素磷(P)还是锂(Li)都是濒临耗尽的紧缺自然资源。显然,从废物中回收P和Li便显得十分重要并突显循环经济之价值。研究基于剩余污泥焚烧灰分中回收的P和Fe以及盐湖/海淡卤水中提取的Li来合成高附加值产品LiFePO4。实验以磷酸三丁酯(TBP)共萃取灰分酸浸液中的H3PO4和Fe3+为原料,将反萃取水相pH调至1.6即可生成FePO4 (31.2 wt% Fe、17.6 wt% P、摩尔比Fe/P=0.98)。有趣的是,Fe3+和H3PO4共萃取过程有机相恰好含有“TBP-FeCl3-煤油”体系,可用于盐湖卤水Li萃取;Li萃取率为78.7%,分离系数(β)为186.0~217.4。此外,Li萃取的化合物是复杂的,主要形式可能是LiFeCl4∙2TBP;Li+可以被4.0 M HCl反萃取,最终以Li2CO3形式回收。此外,用锰离子筛(HMO)吸附和HCl解吸也可从海淡卤水中得到Li2CO3。最后,利用回收的FePO4和提取的Li2CO3合成LiFePO4,得到的LiFePO4产品电化学性能(初始放电容量为69.5 mAh/g和77.8 mAh/g)与工业原料合成的LiFePO4十分接近。相关研究已于近期发表于《Water Research》。
文章亮点01
采用共萃取法回收剩余污泥焚烧灰分酸浸液中的FePO4;02共萃取有机相可用于提取盐湖卤水中的Li;03Li产品亦可通过吸附法从海淡卤水中获得;04回收的FePO4和提取的Li2CO3可合成LiFePO4;05LiFePO4与商业原料合成产品的电化学性能接近。
图文摘要
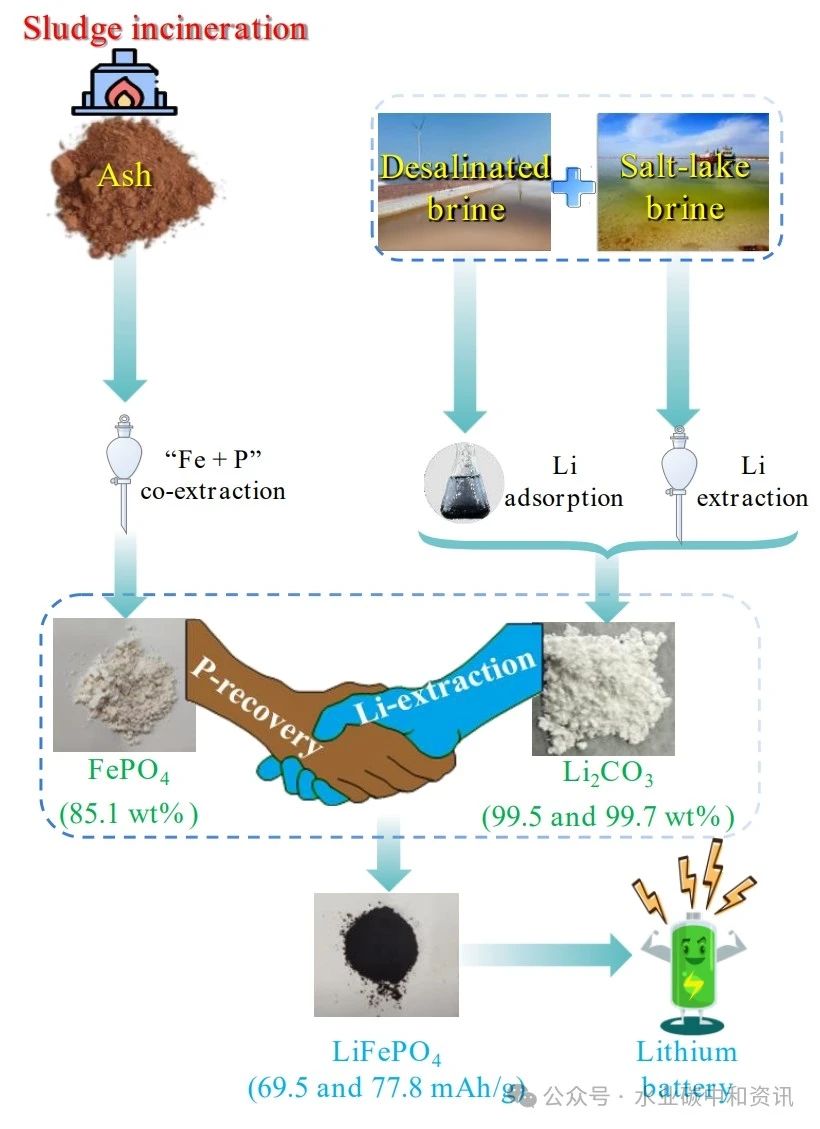
要点内容
01Fe3+与H3PO4共萃取合成FePO4潜在萃取机理:

图1a表明,当O/A≥2.0时,Fe3+萃取率提高幅度较小(70.7%~71.4%),在O/A=2.0时分配系数最大(1.21)。当O/A>2时,H3PO4的萃取率也是缓慢升高(34.2%~39.7%),而分配系数则迅速下降。因此,最优O/A=2:1。根据图1b,随着TBP浓度增加,Fe3+和H3PO4萃取率均提高。总体而言,90 vol.%TBP可较好萃取H3PO4,继续提高TBP浓度对萃取效果影响不大(34.2%~35.7%),且易发生乳化或第三相。图1c 表明,温度越高,H3PO4的萃取效果和分配系数越低。Fe3+萃取也有类似现象,在20℃时分布系数最大。因此,萃取可在20℃进行,并可节约操作成本。
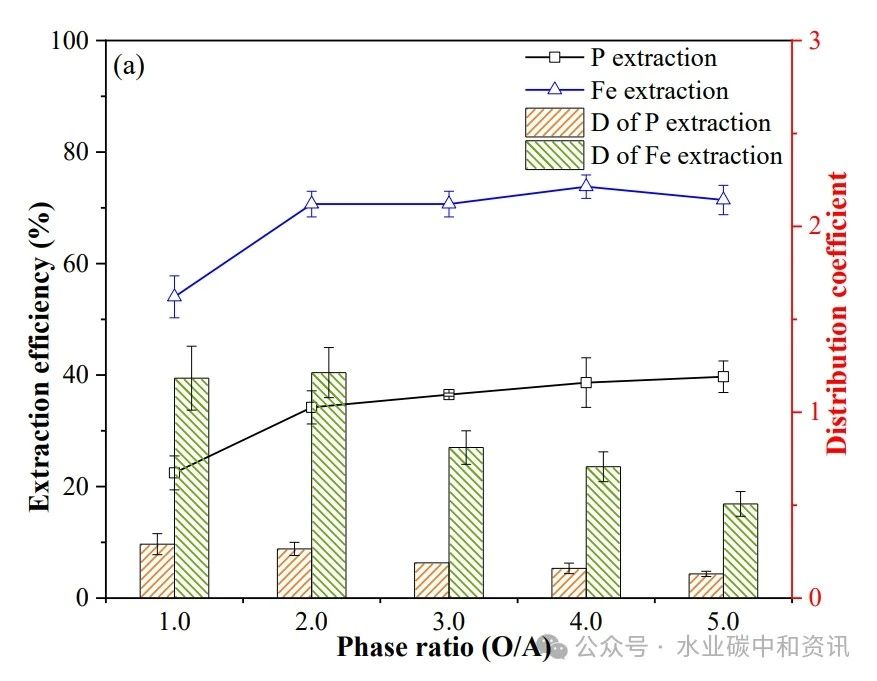



图1 灰分酸浸液Fe和P共萃取:相比(a)、TBP浓度(b)、温度(c)和萃取级数(d)
混合反萃取水相的组成见表S1,极低的有机残留物不会影响FePO4的形成,适当补充Fe或P,使Fe/P的摩尔比为1,从而生产纯净的FePO4产品。萃取过程中的FT-IR和紫外-可见光谱如图S2所示。H3PO4和Fe3+共萃取过程中,可能存在P=O键振动的叠加效应(图S2a)。反萃取后,P=O键的红移减小。由图S2b可知,萃取后峰值强度明显增加,反萃取后强度有所下降,说明Fe3+和Cl-被萃取到TBP中,并结合形成FeCl4- 。图S2c表明回收的FePO4的XRD峰与标准FePO4的PDF#84-0876一致。回收FePO4主要成分P、Fe的质量分数基本达标,Fe/P摩尔比=0.98,杂质含量也符合中国行业标准(HG/T 4701-2021, 2021)。未来通过进一步优化pH调节步骤,可以提高铁和磷的含量。02溶剂萃取法盐湖卤水提锂
“TBP-FeCl3-煤油”体系常被用于盐湖卤水中Li+的选择性萃取。其中FeCl4-是萃取过程中共萃取阴离子,可通过向卤水中加入Fe3+或通过预萃取将Fe3+预负载到有机相中形成。有趣的是,后者恰好是本研究中Fe3+和H3PO4共萃取回收的中间产物。利用上述有机相萃取锂的可能机理如下:

图3a表明,当O/A<2.5时,锂萃取率迅速上升,然后基本平衡(78.7%~82.2%)。当O/A=2.5,Li+对K+、Na+和Mg2+分离系数分别为208.4、186.0和217.4。O/A过高会导致有机相中锂离子浓度降低,后续反萃取水相中Li+难以富集。因此,选择O/A=2.5:1。获得Fe3+和H3PO4共萃取不同O/A下的有机相样品,探索Fe/Li摩尔比对Li萃取影响。随着n(Fe3+)/n(Li+)增大,Li萃取率先升高后降低。当n(Fe3+)/n(Li+)<1.3时,卤水中Li+浓度较低,有利于形成更多的FeCl4-,提高Li+萃取率。之后,Fe/Li继续增大,卤水中高浓度Mg2+、Na+和K+会与过量Fe3+结合,形成Mg(FeCl4)2、NaFeCl4、KFeCl4配合物进入有机相,导致Li+萃取率降低。最佳n(Fe3+)/n(Li+)=1.3。
为避免萃取剂中Fe3+的水解和乳化,需控制卤水保持一定酸度。但是,H+也可以与FeCl4-形成络合物HFeCl4,从而降低锂萃取率。图3c表明,pH=1.5时,可获得最佳的Li+萃取率(78.7%)和β(186.0~217.4)。此外,Li+萃取率和β随温度升高而降低,即TBP萃取锂为放热反应。因此,锂提取操作可在20℃或室温下进行。




图3 盐湖卤水锂萃取的影响:相比(a)、Fe/Li摩尔比(b)、pH (c)和温度(d)
从图4a可知,随着HCl浓度的增加,Li+反萃取率逐渐升高。当HCl浓度为4.0 M时,Li+反萃取率超过83%。高浓度HCl还可抑制H3PO4和Fe3+析出,保证锂产品纯度。继续增加酸浓度易导致设备腐蚀,选择HCl为4.0 M。此外,随着O/A增加,Li+反萃取率迅速下降,但反萃取水相中Li+浓度也被浓缩到7.4 g Li/L,这有利于浓缩结晶操作。此外,较高O/A也可以避免H3PO4和Fe3+的析出,因此选择O/A=20:1。反萃取水相为7.4 g Li/L,然后按理论量1.1倍加入Na2CO3沉淀Li2CO3。03吸附法海淡卤水提锂利用吸附法从海淡卤水中提取锂。图5a表明,HMO投加量增加,锂吸附率缓慢增加。1.0 g HMO/L为锂吸附的最佳投加量,吸附容量为22.8 mg Li/g HMO。杂质离子变化不明显,但Mg2+吸附率高于其他杂质。初始pH=2-12,锂吸附率从5%迅速提高到73%。pH增加,HMO吸附剂表面电负性增强,通过外球络合增加对Li+吸附。此外,较高OH-浓度使HMO中Li+更容易取代H+,有利于Li+嵌入吸附。吸附后溶液pH降低0.5~1.0,也说明吸附过程中发生Li+-H+离子交换。但Mg2+浓度为47 g/L,高pH值导致Mg(OH)2沉淀。因此,选择初始pH为8.0。


图5 海淡卤水锂吸附的影响:HMO投加量(a)、初始pH(b)
图S3表明,当L/S=25 mL/g,HCl浓度从0.05 M增加到1.0 M,锂解吸率增加。在0.5 M HCl浓度下,解吸率接近96.3±0.6%。增加酸浓度容易导致HMO破坏和Mn2+溶解,不利于吸附剂重复利用。因此,选择HCl为0.5 M;得到富锂解吸液Li+浓度为877.9 mg Li/L,可用于后续添加NaOH深度去除Ca2+和Mg2+,浓缩蒸发水分,并投加Na2CO3,得到纯净的Li2CO3产物。04机理分析采用斜率法研究了TBP-FeCl3-煤油体系萃取锂的机理和化学计量学。图6a显示了Li+的分布比例随有机相中TBP浓度(50%-90%)的变化。采用斜率法确定配合物的化学计量学,斜率为2.14,表明两个TBP分子在提取过程中与Li+形成络合物。因此,锂萃取反应如下:
热力学结果列于表2。溶剂萃取总焓变是几个因素的总和,包括:Li(H2O)4+的脱水;金属与萃取剂之间形成萃取配合物;配合物在有机相中的转移;有机相的重排以获得稳定的构型。ΔH<0,说明锂提取过程为放热反应,也验证了该操作应在室温或低温下进行。萃取自由能ΔG<0,说明萃取过程可以自发进行。
表2 锂萃取平衡热力学常数

协同萃取机理如图7所示。首先,Fe3+和H3PO4分别与TBP分子形成络合物,萃取到有机相中。TBP与HFeCl4的络合反应是通过分子轨道互补和表面静电势吸引发生的。可能的萃取机制是FeCl4-首先形成,然后在P=O双键位置与TBP结合形成稳定的六配位共轭栅极HFeCl4·2TBP。TBP和H3PO4的中性络合物萃取机理与Fe3+萃取相似,但其基础是形成氢键,使H2O远离有机相。采用共萃取过程中的有机相作为萃取剂,对盐湖卤水进行锂萃取。Li+第一配位球的首选几何形状为四面体,因此Li+常以水合离子Li(H2O)4+的形式存在于水相中,内层有4个水分子。TBP是一种比水强的路易斯碱,它可以取代Li+的水合水,形成一系列Li配位阳离子。结合上述光谱和化学计量学结果,锂提取后的络合物形态应为LiFeCl4∙2TBP。

图7 Fe3+和H3PO4共萃取以及Li+萃取机理图05
LiFePO4合成及电化学性能图8a表明,合成的LiFePO4与PDF#83-2092一致;可认为是目标产物。有少量峰属于FePO4,是LFP4制备过程中前驱体分散性差或碳层不均匀导致的过还原产物,可能会阻碍Li+的扩散。未来有必要进一步优化FePO4和Li2CO3产物的沉淀结晶工艺。
图8b表明,LFP-c的首次放电容量为89.7 mAh/g,分别比LFP-r1 (77.8 mAh/g)和LFP-r2 (69.5 mAh/g)高15.3%和29.1%。FeP4存在可能会导致Li+嵌入/脱离过程中出现较大的体积变化,进而影响电化学性能。此外,LFP制备涉及多个步骤,前驱体分散和烧制温度均会影响LFP质量,导致其比电容值低于参考值。图8c可知,经过150次循环后,两个回收的LFP产品可提供~50 mAh/g的放电容量,约为初始容量的62%,接近部分文献结果。因此,回收的LFP产品具有一定的商业应用潜力,未来可通过上述优化制备方法或元素掺杂等途径提高其电化学性能。



图8 合成LiFePO4 (LFP)XRD图(a)、首次充放电曲线(b)、循环充放电性能(c) (LiFePO4-c:商业FePO4和商业Li2CO3合成LiFePO4;LiFePO4-r1:回收FePO4和盐湖卤水提取Li2CO3合成LiFePO4;LiFePO4-r2:回收FePO4和海淡卤水提取Li2CO3合成LiFePO4)06主要结论基于废物协同资源化理念,从剩余污泥焚烧灰分中回收磷和铁,从盐湖/海淡浓卤水中提取锂,成功合成了具有高附加值的产品——磷酸铁锂(LiFePO4,LFP)。
通过研究,得出以下主要结论:1)利用TBP可以从灰分酸浸液中共萃取Fe3+和H3PO4,合成FePO4产品。2)共萃取过程中的有机相可用于盐湖卤水中Li+萃取,形成资源回收的协同效应。3)利用HMO吸附法也可从海淡卤水中获得Li产品,拓展锂来源。4)从盐湖和海淡卤水中提取的Li产品,以及从污泥灰分中回收的FePO4产品,可合成具有高附加值的LiFePO4产品,其电化学性能十分接近用工业原料合成的LiFePO4。






