城市供水系统中真菌群落赋存规律解析
导 读
城市供水系统中的耐氯真菌为面向直饮的高品质饮用水供应带来了新的挑战。以某城市供水系统为研究对象,借助培养法、宏基因组测序等方法对水厂不同处理工艺出水和二次供水中真菌的数量和群落结构进行了测定分析。经过水厂净水工艺处理,真菌菌落数有效降低;但相比出厂水,二次供水水箱中的真菌数量出现上升,表明存在真菌再生长风险。出厂水和二次供水中的真菌以根瘤菌属、壶菌属、曲霉属和镰刀菌属为主。曲霉是两水厂出厂水中检出频率和相对丰度最高的致病真菌,3月份最高丰度可达25.19%,建议应作为供水系统重点控制的对象。紫外装置对二次供水中耐氯真菌的数量和致病真菌丰度具有明显的控制效果。
引用本文:赵恒轩,王圣,张天阳,等. 城市供水系统中真菌群落赋存规律解析[J]. 给水排水,2023,49(12):14-20.
为了解城市供水系统种真菌的污染现状,本研究全面考察了中国东部某城市供水系统中真菌的赋存规律,致病真菌的种类和分布,及不同处理工艺的控制效果,以期为供水系统中真菌污染风险的识别与控制策略提供新的见解。
01、材料与方法
1.1 水样采集
水样采集自中国东部某市水厂A和水厂B。水厂A采用长江水源的水库原水,水厂B采用太湖下游湖泊的水库原水。水厂A净水工艺过程依次为原水(DWSS1-RW)-混凝沉淀(DWSS1-SD)-砂滤(DWSS1-SF)-臭氧/活性炭(DWSS1-BAC)-氯胺消毒出水(DWSS1-FW);水厂B净水工艺过程依次为原水(DWSS2-RW)-混凝沉淀(DWSS2-SD)-砂滤(DWSS2-SF)-臭氧/活性炭(DWSS1-BAC)-纳滤(DWSS2-NF)-氯胺消毒出水(DWSS2-FW)。取样点还包括距离水厂A 3 km处的某二次供水设施水样(DWSS1-STW)和二次供水紫外处理后出水,包括慢流速(DWSS1-UV-M),中流速(DWSS1-UV-Z)和快流速(DWSS1-UV-K),分别对应高紫外剂量(44 mJ/cm²)、中紫外剂量(33 mJ/cm²)和低紫外剂量(22 mJ/cm²)。每处采样点使用无菌容器采集20~40 L水样,立即带回实验室处理,或置于4 ℃条件下保存。
1.2 主要试剂、培养基及仪器
DNA提取试剂盒DNeasy PowerSoil Pro Kit(QIAGEN,美国),氯硝唑孟加拉红琼脂培养基Dichloran Rose Bengal Chloramphenicol Agar(DRBC,青岛海博生物技术有限公司),小型离心机Eppendorf 5430 R(Eppendorf,德国),粉碎研磨仪TL-48R(上海万柏生物科技有限公司),测序仪Illumina NovaSeq/Hiseq Xten(Illumina,美国)。
1.3 真菌平板法计数和筛选
将100 mL水样通过0.45 μm无菌滤膜,随后将滤膜置于DRBC培养基正中,滤膜与培养基之间无气泡。将培养基置于25 ℃恒温培养箱中避光培养,每两天观察一次,在第4天记录滤膜上的菌落数(单位CFU/100 mL)。
1.4 水样总DNA提取和高通量测序
将样本水样通过0.22 μm无菌滤膜,随后按DNA提取试剂盒操作说明提取总DNA。文库构建使用NEXTFLEX Rapid DNA-Seq Kit,使用Illumina NovaSeq/Hiseq Xten测序平台进行宏基因组测序。
1.5 测序数据质控与分析
使用fastp软件(https://github.com/OpenGene/fastp版本0.20.0)对读取3′和5′端的适配器序列执行质量裁剪。剪切后去除长度小于50bp、平均碱基质量值小于20和N个碱基的读数,同时保留高质量的双端读数和单端读数。使用将非冗余基因集的氨基酸序列与NR数据库进行比对(BLASTP比对参数设置期望值e-value为10-5)。
02、结果与分析
2.1 供水系统中真菌的数量变化规律
在12月、2月-6月分别对水厂A及二次供水设施、水厂B的各工艺出水进行了平板计数法检测。如图1所示,水厂A和水厂B的原水中,真菌的数量最高可达390 CFU/100 mL。在不同的季节,原水中的真菌数量变化差异较大。在冬季(2月和12月)水厂A和B原水中的真菌数量分别达到最大,而不是微生物活跃的夏季,这可能和取样时的降水情况有关。真菌的最适生长温度在15~25 ℃,但降水可能冲刷地表导致土壤中的真菌进入水库原水中,造成短期真菌数量的上升。经过混凝沉淀、砂滤、臭氧生物-活性炭和氯胺消毒处理后,出厂水中的真菌数量得到了有效的控制。
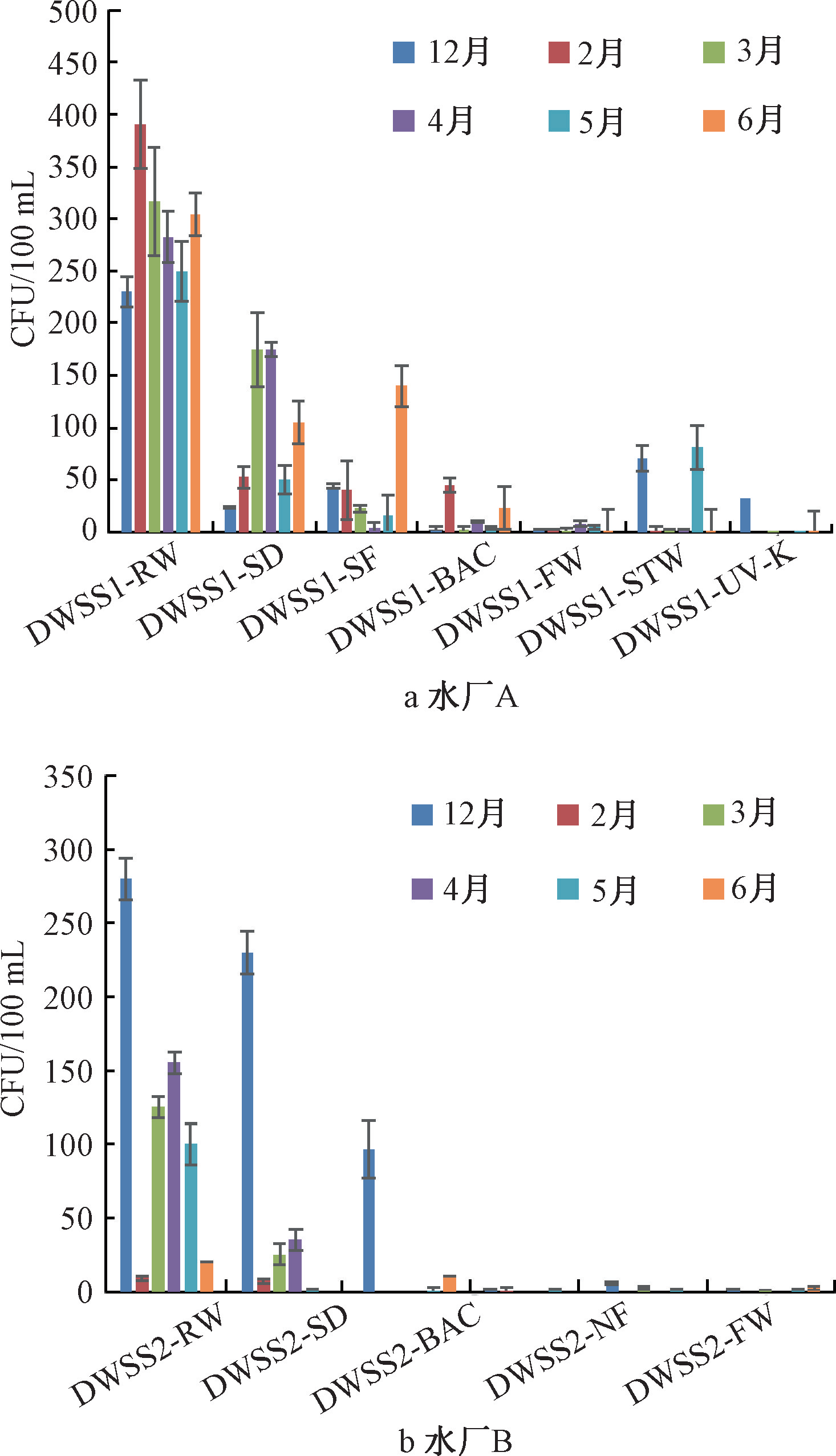
图1 供水系统真菌数量变化
水厂A出厂水中真菌菌落数为0~8 CFU/100 mL,水厂B出厂水中真菌菌落数为0~1 CFU/100 mL。
如图1a所示,经过管网输配后,水厂A供水的某二次供水水箱中真菌的数量有所上升。例如12月二次供水水箱出水的真菌数量高达79 CFU/100 mL,5月真菌数量高达96 CFU/100 mL,表明真菌在供水管网系统中可能存在再生长的风险。经过二次供水设施装备的紫外消毒处理后,12月和5月出水中真菌数量可分别降至31 CFU/100 mL和1 CFU/100 mL。因此紫外消毒未来可能作为水厂或二次供水控制真菌污染的潜在消毒技术。
2.2 可培养真菌的分离和鉴定
如表1所示,通过连续采样检测,在供水系统中共分离出了11种真菌,包括9种霉菌和2种酵母菌。霉菌来自青霉(Penicillium)、木霉(Trichoderma)、枝孢霉(Cladosporium)、拟青霉(Paecilomyces)、曲霉(Aspergillus)等5个属,酵母菌来自囊担菌属(Cystobasidium)和何德霉(Hortaea)属。其中Aspergillus(曲霉属)包括许多风险较高的条件致病真菌。青霉、木霉、枝孢霉、曲霉属中的大部分真菌具有产生嗅味物质的能力,可能会引起供水管网中嗅味物质的再次生成。此外曲霉属中的大部分还具有生成真菌毒素的能力。因此,霉菌是供水系统中需要控制的首要目标。
表1 可培养真菌的种类
2.3 真菌群落结构解析
通过宏基因组(相对定量)对供水系统中真菌群落进行解析。如图2所示,饮用水不同处理工艺对水中真菌的群落结构具有重要的影响。供水系统中真菌的门水平分布主要由子囊菌门(Ascomycota)、毛霉门(Mucoromycota)和担子菌门(Basidiomycota)。其中子囊菌门包含较多已知对人健康有危害的真菌属种,且其相对丰度随着水厂处理工艺从原水到出厂水具有逐渐升高的趋势,在水厂A和水厂B中的变化趋势相近。这可能由于子囊菌门的大多数真菌能够形成具有紧实细胞壁和坚固结构的真菌孢子(繁殖子实体,直径约1~10 μm),因此能够穿过水厂的物理或化学处理屏障。
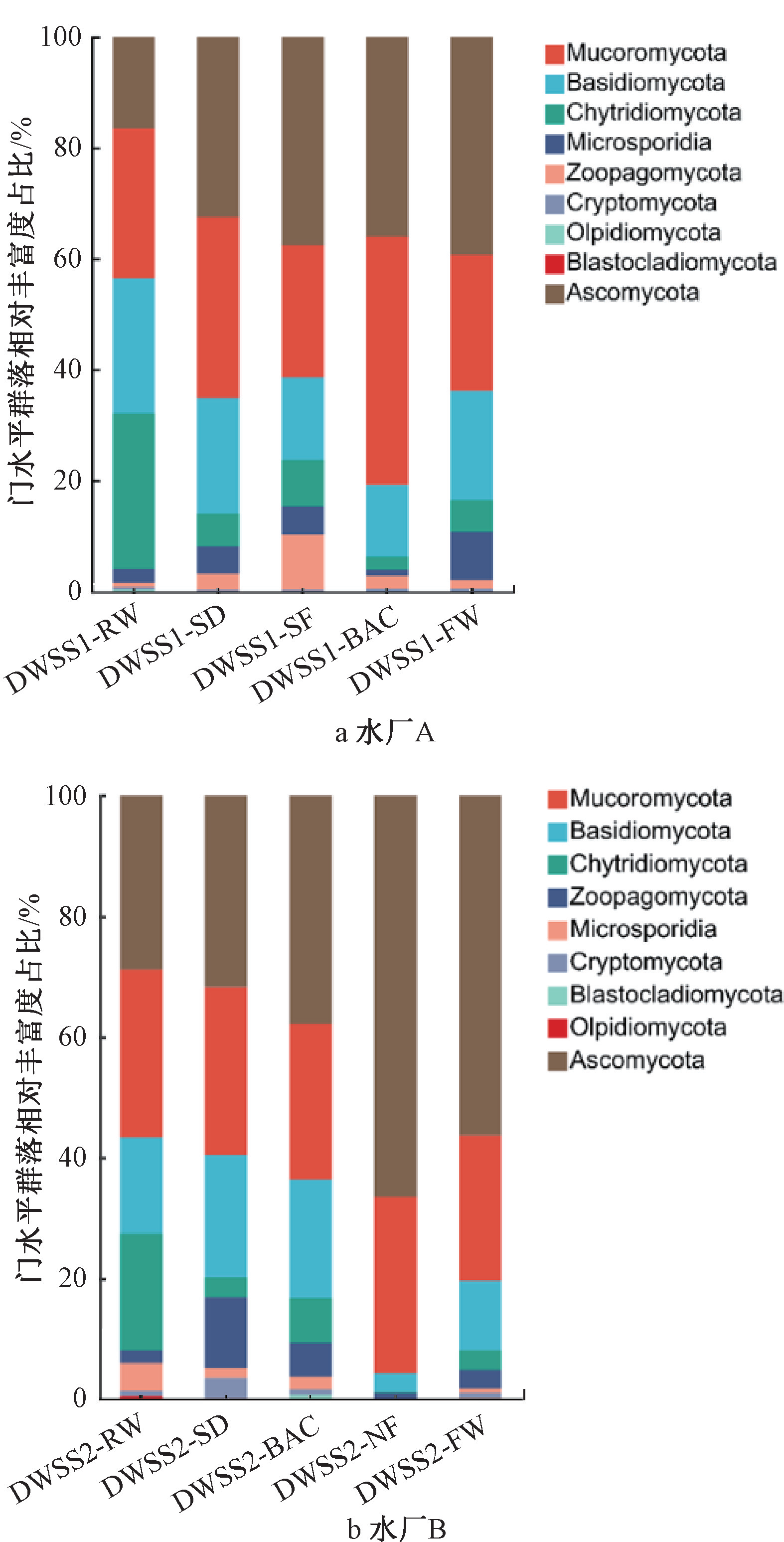
图2 水厂真菌门水平相对丰度变化
图3所示为水厂真菌属水平相对丰度变化。水厂A丰度最高的真菌菌属主要包括根瘤菌属(Rhizopus)、壶菌属(Batrachochytrium)、曲霉属(Aspergillus)、噬根菌属(Rhizophagus)和镰刀菌属(Fusarium)。水厂B丰度最高的真菌菌属主要包括曲霉属(Aspergillus)、根瘤菌属(Rhizopus)、镰刀菌属(Fusarium)、假裸囊菌属(Pseudogymnoascus)和球囊霉属(Glomus)。水厂A臭氧-生物活性炭工艺出水中根瘤菌属(Rhizopus)和曲霉属(Aspergillus)的相对丰度显著增大,这可能和生物活性炭池的微生物泄漏情况有关。在氯胺消毒后,二者的相对丰度得到有效的降低。在水厂B中,纳滤出水呈现出菌落丰度均匀分布的特点。经过氯胺消毒后,曲霉属(Aspergillus)相对丰度出现了明显的增大。这可能是由于某些种类曲霉菌具有较强的耐氯性,因此在穿过消毒屏障后,其相对丰度得到了一定的富集效果。例如土曲霉和烟曲霉灭活2-log所需的CT值为946~1404 mg·min/L,而花曲霉仅为57 mg·min/L。这些具有较高耐氯性的且具有一定致病风险的耐氯真菌,可能对饮用水的生物安全性产生较大威胁。
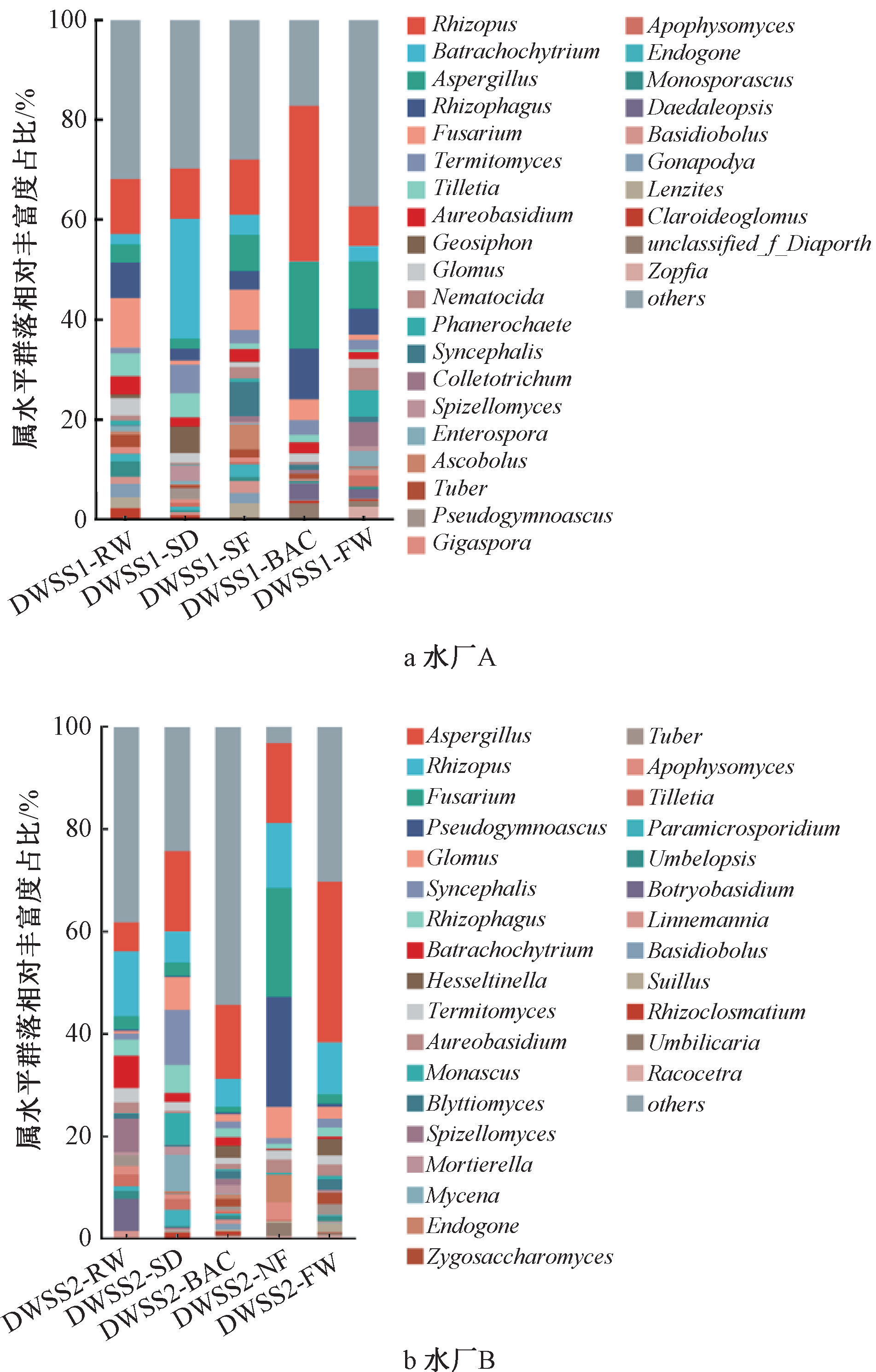
图3 水厂真菌属水平相对丰度变化
图4所示两水厂出厂水真菌丰度对比同样表明,水厂B出厂水中的曲霉属(Aspergillus)相对丰度(75%)为水厂A(25%)的3倍。虽然水厂B增加了纳滤深度处理工艺,但是出厂水中对某些致病真菌的控制效果依然不佳。
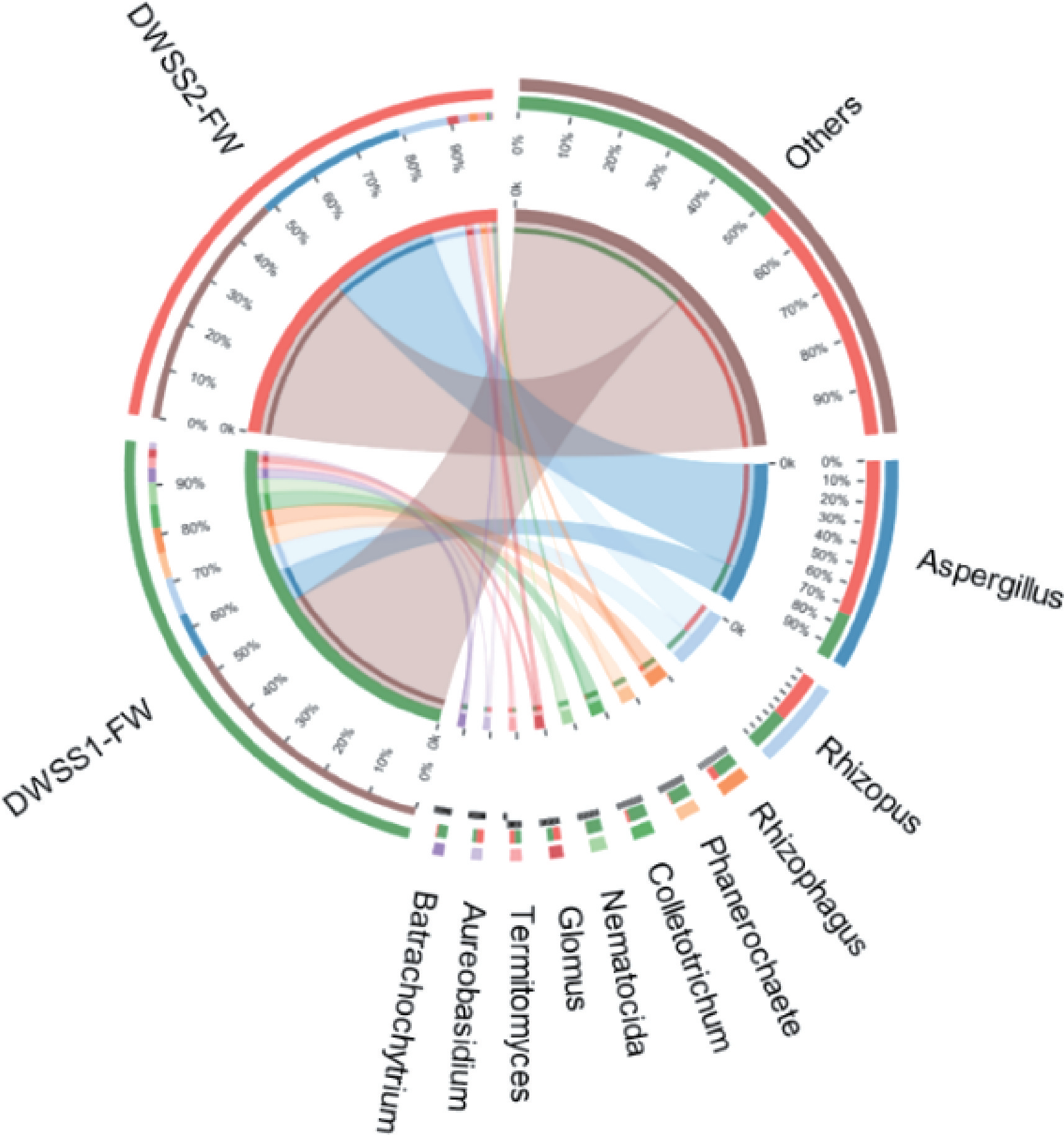
图4 两水厂出厂水真菌丰度对比
图5为水厂A供水(距离水厂A 3 km)的某二次供水水箱及紫外处理后的真菌门水平和属水平变化。经过紫外处理,捕虫霉门(Zoopagomycota)的相对丰度快速降低,而毛霉门(Mucoromycota)的相对丰度上升,在中紫外剂量下最高,表明毛霉门真菌可能对紫外有一定抗性。但随着紫外剂量升高,
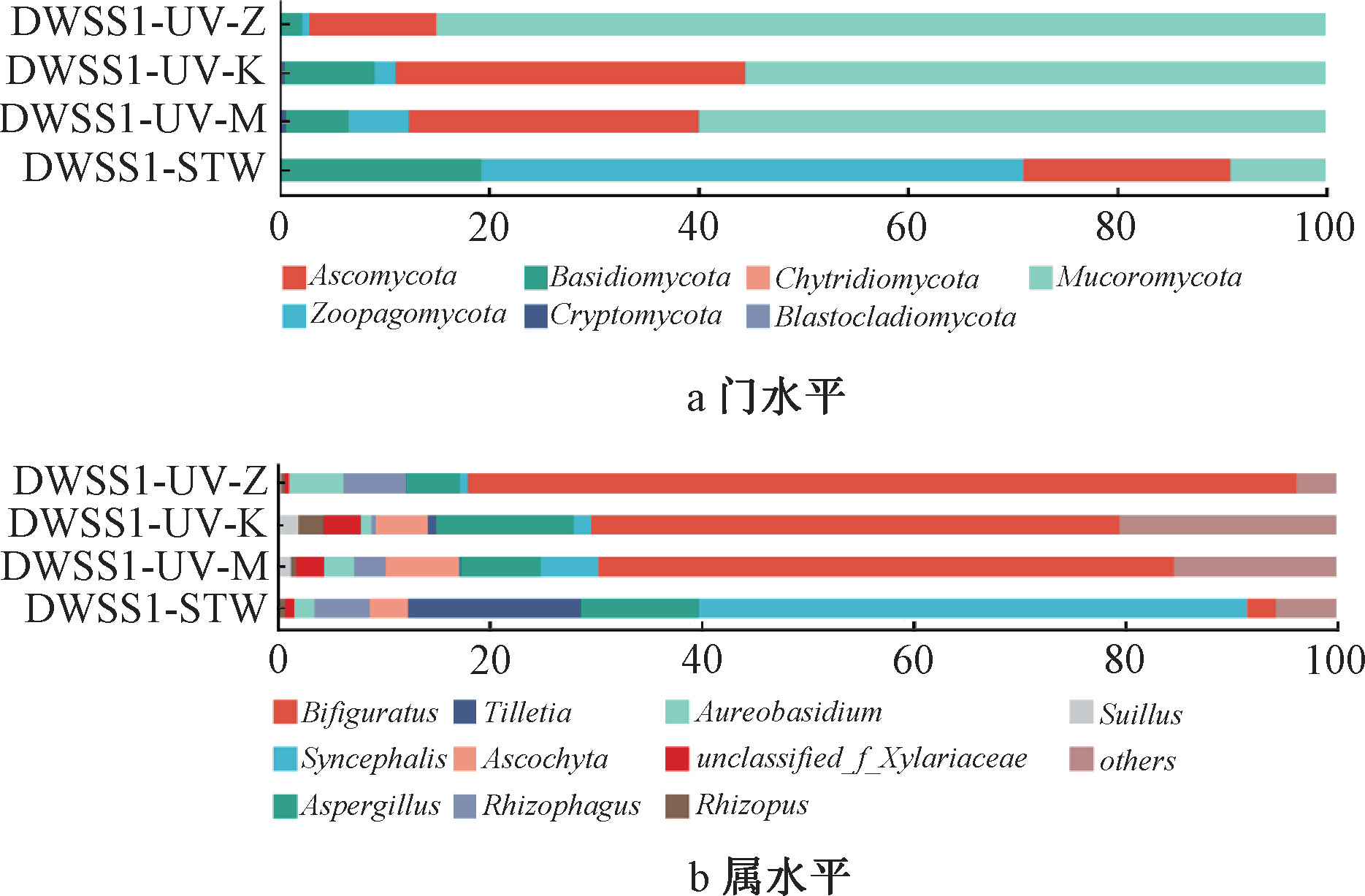
图5 二次供水真菌门水平和属水平变化
毛霉门真菌丰度下降至40%,表明高紫外剂量下对毛霉门真菌存在控制效果。在属水平上,集珠霉属(Syncephalis)经紫外处理后相对丰度快速降低,而Bifiguratus属占比升高。在二次供水设施中,除紫外消毒以外,二氧化氯、臭氧消毒等方式对微生物有较强的杀灭效果,这些不同消毒方式对真菌的控制效果及对群落结构的影响,未来有待更多研究加以评估。
2.4 致病真菌分布
通过冗余分析(RDA),考察了供水系统中5种常见致病真菌的相对丰度与原水环境因子之间的关系,如图6所示,环境变量与真菌之间夹角的余弦值代表了其之间的相关性。若为锐角,便是正相关。可以看出,水厂A原水中镰刀菌、木霉和青霉与浊度、氨氮、UV254及UV272的正相关性较高。水厂B原水中青霉、瓶霉、木霉、曲霉和镰刀菌同样与浊度、氨氮、UV254及UV272的正相关性较高。这4个指标均为判断原水水质好坏的常用基本指标。而致病真菌的相对丰度与pH、温度、总有机碳、硝酸盐-氮、亚硝酸盐-氮、总氮等指标基本呈负相关关系。某些病原真菌在其宿主体内环境下生长繁殖速度更快,例如在较低的pH条件下,可诱导真菌孢子快速萌发,因此原水中致病真菌的相对丰度与pH呈负相关关系。然而其他因素与致病真菌之间呈负相关关系的内在机理还需进一步研究。
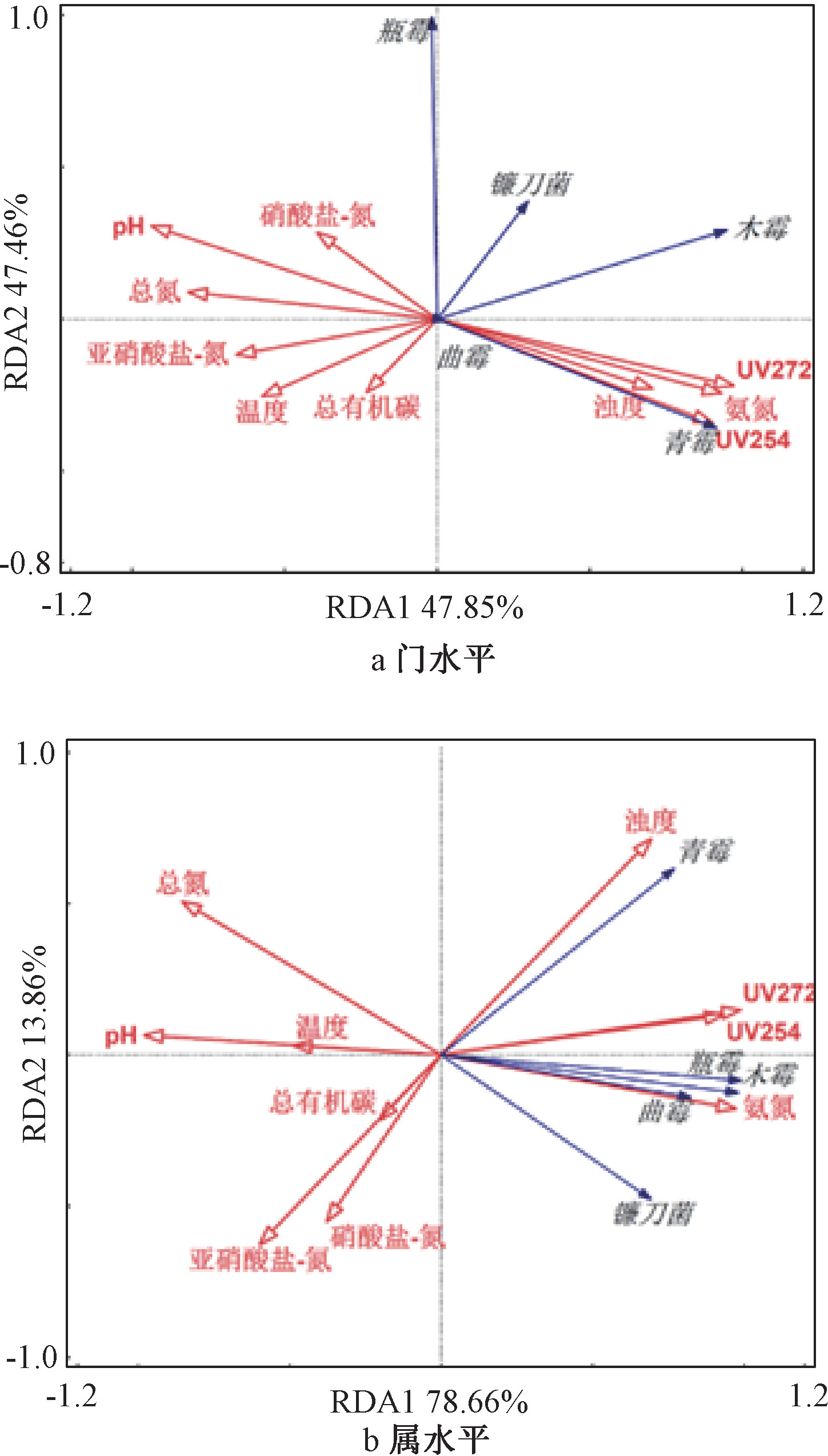
图6 原水致病真菌和水质指标的相关性关系
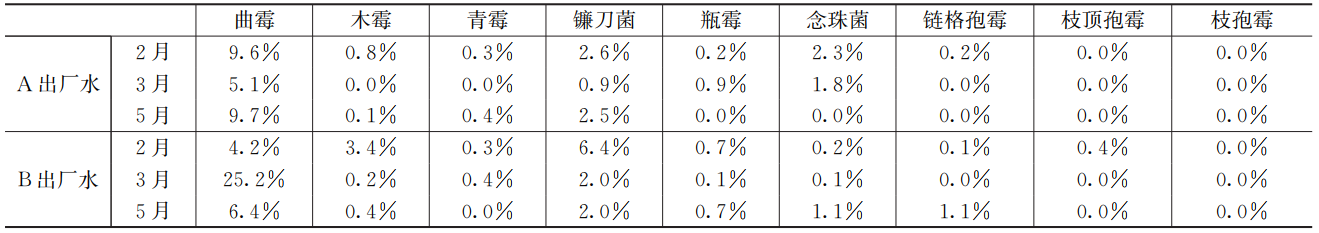
表2列举了水厂A和水厂B的出厂水在2月、3月和5月9种致病真菌的相对丰度分布。在所有致病真菌中,曲霉的相对丰度最高,A出厂水中为5.1%~9.7%,B出厂水中为4.2%~25.2%,3月最高。其次为镰刀菌,A出厂水中为0.9%~2.6%,B出厂水中为2.0%~6.4%,2月最高。曲霉属和镰刀菌属能够引发过敏、过敏性肺炎、鼻炎和哮喘,某些甚至会引起免疫功能损伤,并对免疫功能低下者造成侵袭性感染。美国阿肯色州大学医学院认为镰刀菌属可能是真菌侵染的环境来源。
表2 出厂水致病真菌相对丰度分布
另一项研究表明,医院的水系统可能是医院内免疫功能低下患者曲霉菌病的一个重要来源。
03、结 论
调查了中国东部某市城市供水系统中真菌的赋存情况。两水厂可以将真菌数量从原水的最高390 CFU/100 mL降低至出厂水的 <10 CFU/100 mL,但经过管网输送,二次供水水箱内的真菌数量有所上升。通过筛选分离出了11种真菌,以霉菌为主。供水系统中真菌主要由子囊菌门(Ascomycota)、毛霉门(Mucoromycota)和担子菌门(Basidiomycota)组成,相对丰度最高的包括根瘤菌属(Rhizopus)、壶菌属(Batrachochytrium)、曲霉属(Aspergillus)和镰刀菌属(Fusarium)等。二次供水的紫外装置可以有效控制真菌数量,并对真菌群落结构造成较大影响。原水中致病真菌与浊度、氨氮、UV254和UV272等指标具有较强的正相关性。饮用水厂出厂水中曲霉属和镰刀菌属是相对丰度最高的致病真菌。