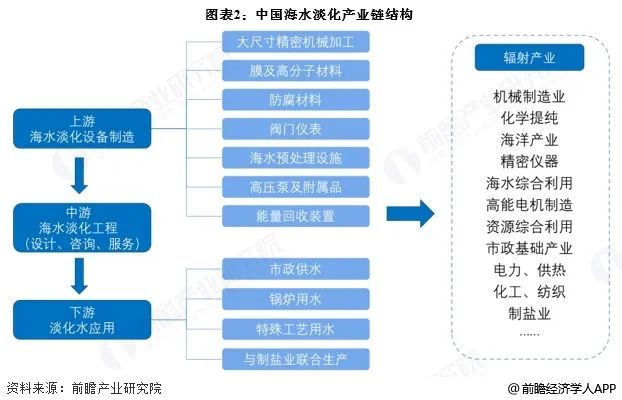
硝化与异养细菌内源衰减特征探究
编者按:作为微生物内源过程的一个重要组成部分,细菌衰减可分为由细胞死亡引起的数量衰减和由细胞活性降低引起的活性衰减两部分,并与系统中生物量多寡直接相关。深入认识这一过程对优化生物营养物去除(BNR)工艺系统运行具有重要作用。因此,与营养物去除密切相关的细菌(如,硝化菌、聚磷菌等)衰减速率测定受到关注。本期就活性污泥中硝化细菌(AOB和NOB)与异养细菌(OHOs)内源衰减特征进行定量分析。通过衰减速率测定实验、LIVE/DEAD染色和FISH实验,定量分析了三者在好氧环境下的衰减特征。结果表明,在硝化系统中,由活性降低引起的AOB和NOB衰减贡献率分别为47%和82%,由细胞死亡引起的AOB和NOB衰减贡献率分别为53%和18%。在异养系统中,由活性降低引起的OHOs衰减约占78%,而细胞死亡导致的衰减约占22%。三者由细胞死亡引起的衰减差异可能是由于底物贮存能力和/或OHOs隐性生长/死亡再生机制引起的。此外,AOB和NOB可利用的能源底物不同可能是由细胞死亡引起的NOB衰减贡献率相对较小的原因。本文发表于《Water Research》(2009年5月)
文章亮点
1、在污水生物处理系统中,细菌细胞衰减实质上可以分为由生物量减少(细胞死亡)引起的数量衰减和由细胞活性降低引起的活性衰减两部分;
2、通过衰减速率测定、LIVE/DEAD染色和FISH实验析知,AOB和NOB衰减速率分别为0.144 d-1和0.306 d-1。其中,二者死亡速率分别为0.076 d-1和0.054 d-1。进言之,细胞死亡对降低AOB和NOB活性的影响比例分别为53%和18%。
3、异养系统中,OHOs衰减速率和死亡速率分别为0.029 d-1和0.046 d-1。且细胞死亡和活性衰减对OHOs活性降低的贡献分别为22%和78%。
4、三者由细胞死亡引发的衰减特征存在的差异可能是由于利用外源底物能力差异与隐性生长现象存在。
1 引言
活性污泥中细菌活性衰减可归因于细胞死亡和活性降低。显然,定量分析二者在细胞衰减过程中的作用能够明晰细菌面临不利生存因素时的应对策略,进而优化生物营养物去除(BNR)工艺系统运行(可参阅往期内容《污水物处理系统中微生物内源过程》)。因此,衰减速率的测定受到广泛关注,特别是对于生长速率缓慢的硝化菌。基于此,本文通过常规耗氧速率(OUR)测定方法、荧光原位杂交技术(FISH)以及LIVE/DEAD细胞活性实验定量分析氨氮氧化细菌(AOB),亚硝酸氮氧化细菌(NOB)和常规异养菌(OHOs)的细胞死亡和活性降低对微生物活性的影响程度。旨在加深对活性污泥系统中硝化细菌细胞衰减特征的认识。
2 材料与方法
2.1 自养硝化系统
衰减实验所用硝化菌泥样来自实验室小型SBR反应器(总体积为5 L,工作体积为4 L)。HRT=12 h,SRT=10 d,工作周期6 h,温度=30±0.5 ℃。实验采用人工配水(如表1所示)。系统稳定时混合液悬浮固体(MLSS)为680±10 mg/L。
表1 自养硝化系统进水组分

2.3 衰减实验和衰减速率的测定
实验中通过测定最大耗氧速率(OUR)的变化来确定细菌衰减速率。测定分3个阶段进行(持续时间分别为5,5和3 min),测定过程如图1所示。
1)在不加入底物的情况下,测量其在内源呼吸阶段的OUR,即OUR1;
2)加入NaNO2溶液(使其中NO2-浓度为20 mg N/L),测得NOB的OUR,即OUR2;
3)加入NH4Cl溶液(使其中NH4+浓度为100 mg N/L),测定AOB的OUR,即OUR3。
根据表3所示的公式,可分别计算AOB和NOB的OUR。并通过线性回归的方法,计算出AOB和NOB的衰减速率。

图1 测定细菌OUR三阶段
表3 AOB和NOB衰减速率计算方程

OHOs的OUR测定相对简单:向反应体系中添加400 mg/L COD进行OUR测定。
2.4 LIVE/DEAD 染色及FISH实验
此外,还采用荧光染料对衰减过程中泥样染色,以确定泥样衰减过程中活细菌细胞占总细菌细胞比例的变化规律。以及利用FISH技术确定AOB和NOB在系统中的占比。
2 结果与讨论
3.1 自养硝化系统
3.1.1 AOB和NOB的衰减速率
图2为AOB和NOB在好氧衰减过程中OUR的变化规律。可知,在最初的饥饿状态下AOB和NOB活性均稳步下降。二者在衰减过程(7 d)中的平均衰减速率分别为0.144±0.008 d-1和0.306±0.026 d-1,其变化趋势(bAOB<bNOB(p<0.01))与其他相关研究基本一致,但具体衰减速率值有所不同。这可能源于不同SRT的设置。即,较长SRT可以通过较低的衰减速率来选择那些具有更好生存策略的硝化菌。
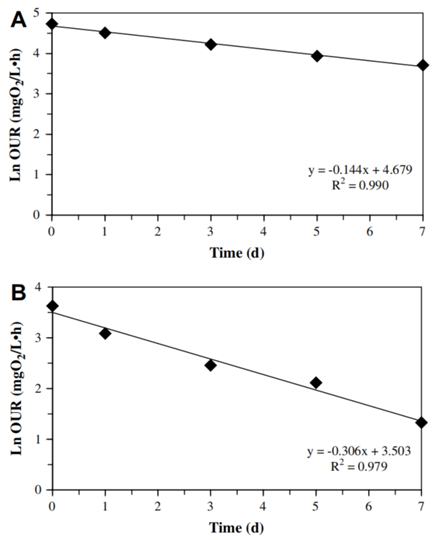
图2 好氧衰减过程中AOB(A)和NOB(B)的OUR变化
FISH实验结果如图3所示。可知,在7 d的衰变期间,AOB、NOB和OHOs的组分没有显著变化(p>0.05),平均组分分别为50±5%,30±3%和20±6%。其中,OHOs可能是基于AOB和NOB细胞裂解液或代谢产生的碳源生长。
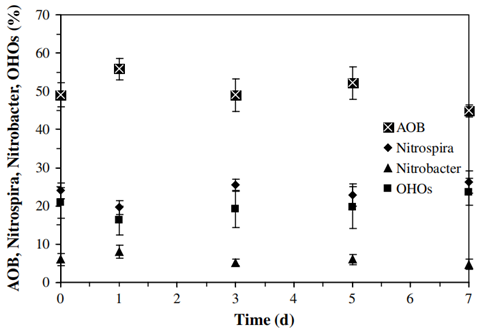
图3 AOB、NOB和OHOs的FISH定量结果
3.1.2 AOB和NOB的死亡速率
硝化系统泥样衰减过程中的LIVE/DEAD染色结果如图4所示。可知,硝化系统泥样在衰减过程中活细胞在总细胞数量中的比例呈匀速下降的趋势。考虑到泥样中生物体总量会因细胞自溶以及高等微生物的捕食而减少。因此,根据活细胞比例变化并结合MLVSS变化以及FISH实验结果,由等式(5)计算得出AOB和NOB死亡速率分别为0.076±0.006 d-1和0.0.054±0.009 d-1,结果如图5所示。
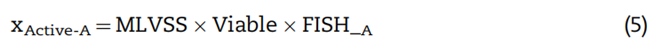
式中:Viable为活菌占总细菌比例;FISH_A为活AOB和NOB占总活菌比例。
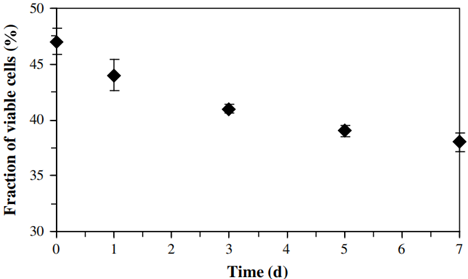
图4 硝化泥样在衰减过程中的活菌占比变化
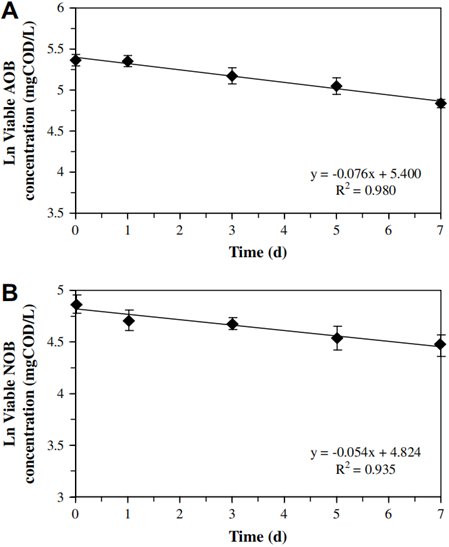
图5 衰减过程中活AOB和NOB变化
通过对比硝化系统中活细胞的死亡速率与总细菌细胞的平均衰减速率可知,AOB和NOB的死亡速率低于后者。结果表明,AOB和NOB细胞死亡引起的衰减贡献率分别为53±5%和18±3%,由其活性降低引起的衰减贡献率分别为47±5%和82±3%。显然,以OUR和底物分解速率为基础的测定方法难以区分细胞死亡和活性衰减。这也是实际应用中将二者混淆一谈的原因。例如,若活性污泥数学模型中仅将细胞衰减假设为由细胞死亡所引起而不考虑参数(衰减系数)适当校正,势必导致模拟结果与实际情况出现一定偏差。
3.2 异养硝化系统
OHOs在衰减过程中最大OUR值变化情况如图6所示。可知,OHOs活性在衰减过程中稳步下降,与AOB和NOB相似。根据前述计算方法,OHOs衰减速率为0.209±0.011 d-1。
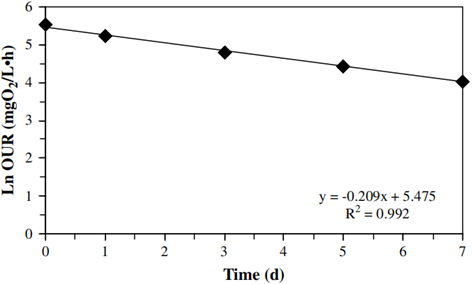
图6 好氧衰减过程中异养细菌OUR变化
此外,异养污泥中活细胞在总细胞中占比也呈匀速下降趋势(p<0.05),如图7所示。并且根据等式(6)可计算得活OHOs浓度。最后可计算得异养系统中OHOs死亡率为0.046±0.002 d-1,如图8所示。与硝化细菌相比,由细胞死亡引起的OHOs衰减仅有22±2.2%。这意味着由活性降低引发的衰减是导致OHOs活性下降的主要原因,其高达78±2%。
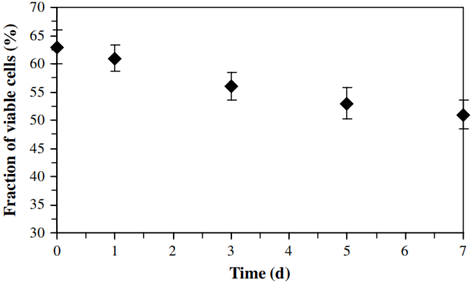
图7 异养系统泥样衰减过程中活细胞比例的变化规律

式中:Viable为活菌与总细菌的比例;FISH_H为测定活菌OHOs与总活菌的比值。
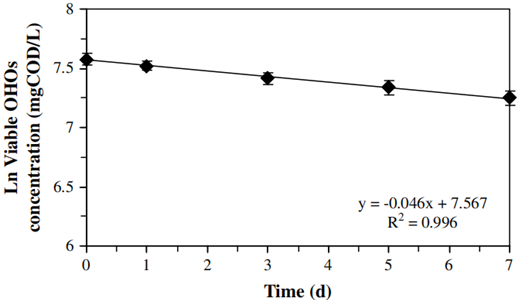
图8 衰减过程中活OHOs变化
3.3 由细胞死亡引发AOB和OHOs活性降低的差异
以上述结果可知,由细胞死亡引起的AOB衰减比例远高于OHOs(p<0.01),如图9所示。有研究指出,OHOs的衰减很大一部分是由于胞内酶调节(enzymatic regulation)。因此,由细胞死亡引起的OHOs衰减比例较低。
此外,这也可能与细胞底物在细胞内的机制有关。OHOs在外源底物存在的条件下能够将其迅速贮存为胞内聚合物,如PHA和糖原。当外源底物消耗殆尽时,OHOs能够利用胞内聚合物实现生长和细胞维持。在长时间的饥饿条件下,异养细菌甚至能够氧化分解蛋白质、RNA等细胞组织以提供能量避免死亡。而AOB则无法贮存和利用胞内物质,其细胞维持的能量均来自于对外源底物的分解。
基于此,OHOs相较于AOB的抗冲击负荷能力更强,故其衰减主要表现为活性的降低而不是细胞死亡。AOB则反之。
此外,OHOs在衰减过程中也可能出现了大规模细胞死亡现象,但其能够分解自身细胞的死亡自溶体并获取底物(碳、氮源)实现二次生长/隐性增长。显然,隐性生长生成了新的活性细胞体,补偿了死亡细胞的数量。其中,虽然氮源(AOB的能源)也是由于细胞衰变而产生,但与碳源相比,其数量很小(假设一个标准的生物量公式为C5H7NO2),且可能主要被OHOs同化。因而可以忽略AOB的隐性增长。进而表现为OHOs的细胞死亡比例相对较小。有研究测得细菌Klebsiella pneumoniae隐性生长的产率系数为0.42~0.52。因此,在研究OHOs的细胞衰减时,应对其隐性生长的过程给予足够的重视。
3.4 由细胞死亡引发AOB和NOB活性降低的差异
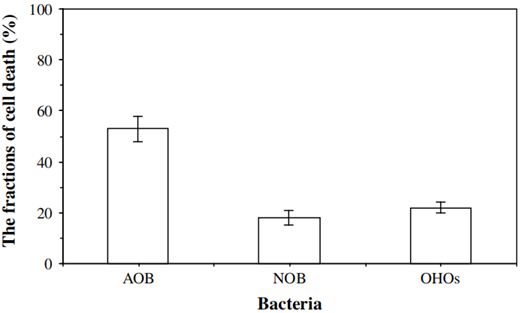
图9 由细胞死亡引发的AOB、NOB和OHOs活性降低
如图9所示,由细胞死亡引起的AOB衰减比例亦远高于NOB(p<0.01),这可能与AOB和NOB所需的营养来源不同有关。AOB为自养微生物,而NOB被认为是兼性自养生物。即,除了NO2-外,它们还可以利用碳源作为能源。因此,与OHOs类似,NOB也可以利用死亡细胞产生的衰变产物进行隐性增长,从而补偿死亡细胞数量。
4 结论
1通过衰减速率测定实验,测得硝化SBR系统(T=30 ℃,SRT=10 d)中AOB和NOB衰减速率分别为0.144 d-1和0.306 d-1。
2根据LIVE/DEAD细胞染色实验和FISH验证,AOB和NOB死亡速率分别为0.076 d-1和0.054 d-1。细胞死亡对降低AOB和NOB活性的影响比例分别为53%和18%。
3通过最大OURs测定和LIVE/DEAD细胞染色实验可得异养系统(T=25 ℃,SRT=10 d)中OHOs衰减速率和死亡速率分别为0.029 d-1和0.046 d-1。这意味着细胞死亡和活性衰减对OHOs活性降低的贡献分别为22%和78%。